Memahami Konfigurasi Elektron dan Diagram Orbital Lebih Mudah| Kimia Kelas 10

Konfigurasi elektron dan diagram orbital akan dibahas pada artikel ini dengan mudah dari contoh dalam kehidupan sehari-hari dan lingkungan sekitar
—
Apa sih yang ada di pikiran kamu waktu dengar kata “kimia”? Cairan warna-warni? Kebanyakan orang pasti berpikir begitu. Ada yang warnanya ungu, hijau, biru, dan warna-warna lainnya. Tapi tentu saja nggak semua zat kimia punya warna-warna menarik, teman. Zat-zat yang punya konfigurasi elektron dan diagram orbital tertentu saja yang punya warna menarik. Wow, apaan tuh konfigurasi elektron dan diagram orbital? Cekidot!
Konfigurasi Elektron
Konfigurasi elektron adalah susunan elektron berdasarkan kulit atau orbital dari suatu atom. Jadi ada dua cara menyatakan konfigurasi elektron nih. Namun konfigurasi elektron berdasarkan orbital atom itu, lebih berguna untuk mempelajari sifat-sifat suatu zat kimia, termasuk mengapa ada zat kimia yang berwarna-warni. Jadi yang dibahas di sini adalah bagaimana membuat konfigurasi elektron berdasarkan orbital suatu atom ya.
Nah, ada satu gambar yang harus kalian pahami dulu sebelum membuat konfigurasi elektron berdasarkan orbital atom. Coba perhatikan gambar di bawah ini.

Wow, apa tuh? Uler-uleran? Bukan dong. Itu adalah urutan tingkat energi kulit dan subkulit suatu atom. Ada 4 subkulit yaitu s, p, d, dan f dan angka sebelum subkulit menunjukkan kulit. Subkulit 1s punya tingkat energi paling rendah, lalu naik ke subkulit 2s, 2p, 3s, 3p, sampai terakhir yang paling tinggi 8s. Pastinya elektron yang bisa mengisi subkulit tertentu juga terbatas. Elektron yang mengisi subkulit ini dituliskan dalam bentuk pangkat. Subkulit s maksimal terisi 2 elektron ![]() , p terisi 6 elektron (p6), d terisi 10 elektron
, p terisi 6 elektron (p6), d terisi 10 elektron ![]() , dan f terisi 14 elektron
, dan f terisi 14 elektron ![]() .
.
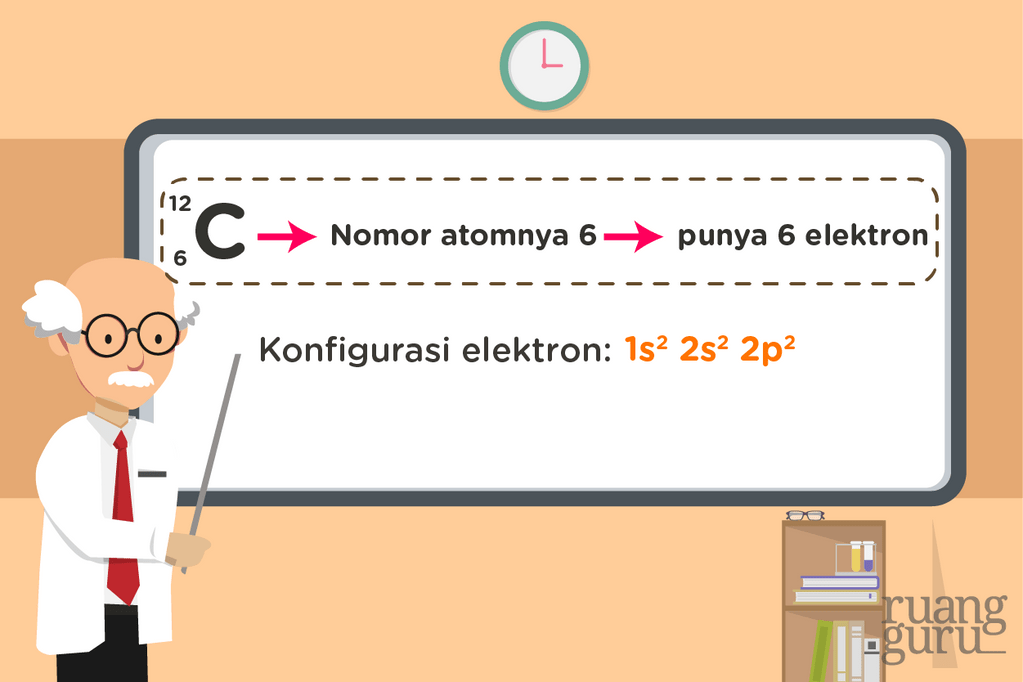
Saat menuliskan konfigurasi elektron, kita harus menuliskannya secara urut berdasarkan tingkat energi subkulit dari yang terendah ke tertinggi. Coba nih lihat contoh konfigurasi elektron atom karbon.
Baca juga: Mengenal Partikel dan Notasi Atom
Kok bisa gitu ya konfigurasi elektron atom karbon? Coba kita ulik satu persatu ya. Karbon punya 6 elektron. Kita harus menuliskan konfigurasi untuk 6 elektron ini. Padahal elektron yang menempati suatu subkulit bisa dilihat dari pangkat subkulitnya. Kalau kita jumlahkan pangkatnya dari 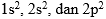 maka pas 6 kan? Jadi, dalam menuliskan konfigurasi elektron, ikuti saja urutan tingkat energi kulit dan subkulitnya sampai pangkatnya sama seperti banyaknya elektron yang dipunyai atom itu.
maka pas 6 kan? Jadi, dalam menuliskan konfigurasi elektron, ikuti saja urutan tingkat energi kulit dan subkulitnya sampai pangkatnya sama seperti banyaknya elektron yang dipunyai atom itu.
Terus zat kimia dengan konfigurasi elektron seperti apa ya yang bisa menghasilkan warna? Biasanya, zat kimia dari logam transisi (golongan B) yang bisa menghasilkan warna. Ambil contoh Mangan (Mn). Seperti apa tuh konfigurasi elektron mangan? Coba perhatikan gambar di bawah ini.
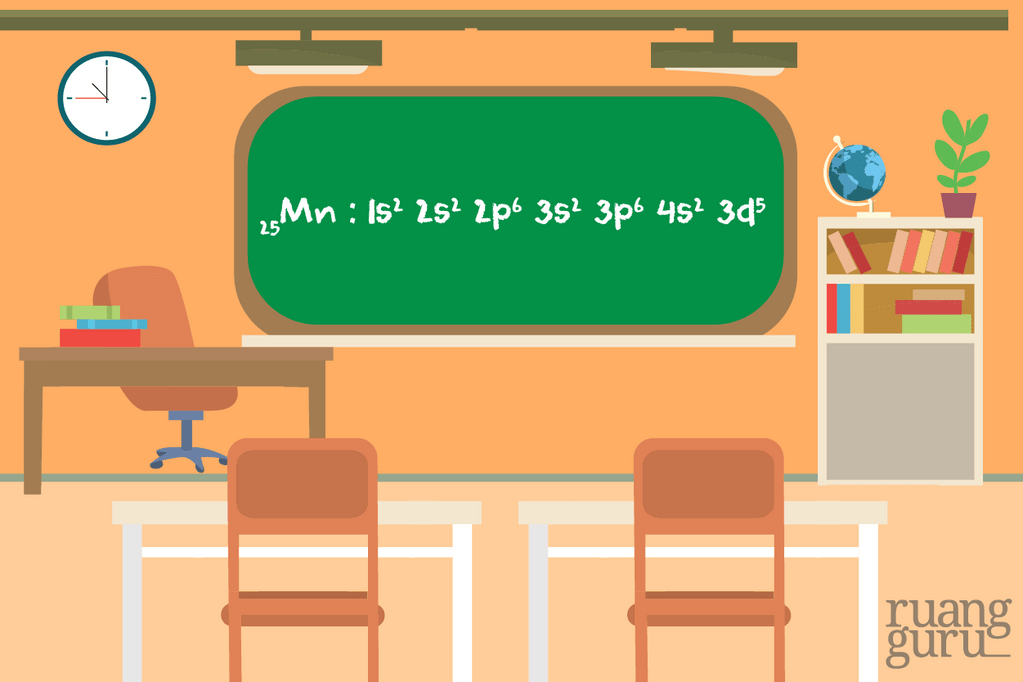
Mn punya subkulit d di akhir konfigurasi elektronnya kan? Subkulit d ini yang biasanya akan mengalami proses kimia lebih lanjut sehingga menghasilkan warna. Itu sebabnya sebagian besar zat kimia dari logam transisi bisa menghasilkan warna. Gimana? Paham kan? Kalau sudah, kita lanjut, yuk!
Diagram Orbital
Nah sekarang kita akan menggambarkan konfigurasi elektron memakai diagram orbital, teman. Sebenarnya gambarnya cukup mudah kok. Suatu subkulit punya sejumlah orbital. Orbital itu digambarkan sebagai persegi dan berisi garis setengah panah yang mewakili elektron. Subkulit s punya 1 orbital, p punya 3 orbital, d punya 5 orbital, dan f 14 orbital. Ada aturan-aturannya lho dalam menggambar diagram orbital.

Kalau sudah tahu aturan-aturannya, langsung aja deh kita lihat contoh diagram orbital untuk beberapa atom berikut.
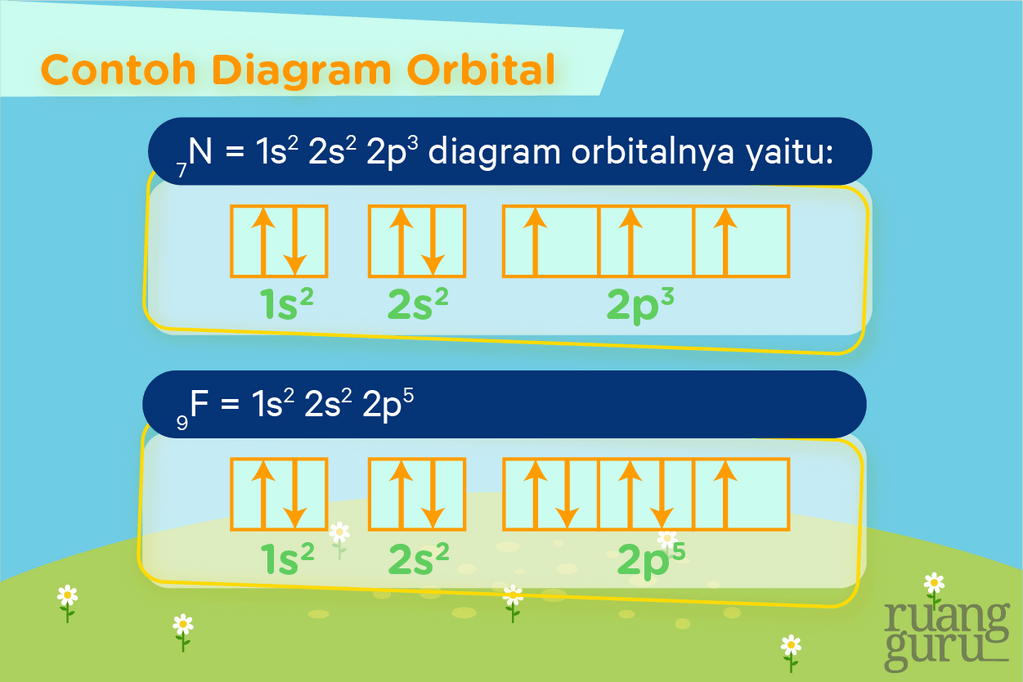
Sama seperti konfigurasi elektron, diagram orbital juga dipakai diperlukan untuk mempelajari mengapa zat-zat kimia mempunyai warna lho. Diagram orbital bisa menggambarkan mengapa ada zat yang warnanya ungu, hijau, atau bahkan tidak berwarna walaupun ia merupakan logam transisi. Misalnya pada logam transisi yang tidak berwarna Zn, bila kita gambarkan diagram orbitalnya, akan terlihat perbedaan diagram orbital antara logam itu dengan logam transisi berwarna lain.

![[AB] Web Side Banner - Blog RG](https://cdn-web-2.ruangguru.com/landing-pages/assets/399009fa-feaf-4b6c-8321-92409d53a26a.png)














