Latihan Soal UNBK SMA Kimia Tahun 2020

Artikel ini memberikan latihan soal UNBK SMA untuk mata pelajaran Kimia tahun 2020
—
UNBK 2020 sudah semakin dekat ya. Apakah kamu sudah melakukan persiapan yang cukup untuk menghadapinya? Yakin, sudah siap? Agar kamu lebih siap lagi, ayo mulai perbanyak latihan soal-soal dengan latihan soal UNBK SMA Kimia tahun 2020 berikut ini.
Baca juga: Latihan Soal UNBK SMA Matematika IPA Tahun 2020

Topik : Ilmu Kimia dan Ruang Lingkupnya
Subtopik : Metode Ilmiah
Level : LOTS
1. Berikut ini adalah tahapan-tahapan metode ilmiah:
- Menguji hipotesis
- Merumuskan masalah
- Menarik kesimpulan
- Identifikasi masalah
- Menyusun dasar teori
- Menyusun hipotesis
Urutan metode ilmiah yang benar adalah ….
- 4) – 2) – 5) – 6) – 1) – 3)
- 4) – 2) – 1) – 6) – 3) – 5)
- 4) – 1) – 5) – 2) – 6) – 3)
- 5) – 4) – 2) – 1) – 3) – 6)
- 5) – 2) – 6) – 1) – 3) – 4)
Jawaban: A
Pembahasan:
Metode ilmiah adalah langkah-langkah rasional dan ilmiah untuk mengungkapkan suatu masalah. Urutan tahapan metode ilmiah yaitu:
- Identifikasi masalah
- Merumuskan masalah
- Menyusun dasar teori
- Menyusun hipotesis
- Menguji hipotesis
- Menarik kesimpulan
Urutan yang tepat adalah 4) – 2) – 5) – 6) – 1) – 3).

Topik : Struktur Atom dan Sistem Periodik Unsur
Subtopik : Pendahuluan Struktur Atom
Level : MOTS
2. Unsur A terletak pada golongan VIA periode 3 dan memiliki massa atom relatif sebesar 32. Jumlah proton dan neutron unsur A adalah ….
- 16 dan 16
- 16 dan 17
- 17 dan 15
- 18 dan 13
- 15 dan 17
Jawaban: A
Pembahasan:
Golongan VIA periode 3, artinya:
Elektron valensi berada pada s dan p berjumlah 6, yaitu s2 p4
Periode = jumlah kulit = 3, maka:
Konfigurasi elektron valensi : 3s2 3p4
Konfigurasi lengkap unsur A : 1s2 2s2 2p6 3s2 3p4
Untuk atom netral, Nomor atom = nomor elektron = 2 + 2 + 6 + 2 + 4 = 16
Nomor atom = nomor proton = 16
Nomor neutron = nomor massa – nomor proton
= 32 – 16
= 16

Topik : Gaya Antarmolekul
Subtopik : Ikatan Hidrogen
Level :LOTS
3. Dibanding asam halida yang lain, senyawa HF memiliki titik didih yang paling tinggi. Hal ini disebabkan karena pada senyawa HF terdapat ….
- Ikatan kovalen
- Ikatan hidrogen
- Ikatan elektrovalen
- Ikatan ionik
- Ikatan logam
Jawaban: B
Pembahasan:
Senyawa HF memiliki titik didih paling tinggi dibandingkan senyawa halida (HX) lainnya, hal ini disebabkan pada senyawa HF terdapat ikatan hidrogen. Ikatan hidrogen bersifat sangat kuat, sehingga dibutuhkan energi yang lebih besar untuk memtusukan ikatan hidrogen.
Ikatan hidrogen adalah ikatan antarmolekul yang terjadi antara atom H dan atom dengan elektronegatifitas tinggi seperti F, O, dan N.

Topik : Stoikiometri
Subtopik : Perhitungan kimia dalam suatu persamaan reaksi
Level : HOTS
4. Sebanyak 5 gram CaCO3 direaksikan dengan 100 mL HCl 0,5 M menurut reaksi berikut:
CaCO3 (s) + HCl (aq) -> CaCl2 (aq) + H2O (g) + CO2 (g) (reaksi belum setara)
Volume CO2 yang terbentuk jika diukur pada suhu kamar sebanyak ….
- 0,2 L
- 0,4 L
- 0,6 L
- 0,8 L
- 1,0 L
Jawaban: C
Pembahasan:
Setarakan reaksi terlebih dahulu:
CaCO3 (s) + 2HCl (aq) -> CaCl2 (aq) + H2O (g) + CO2 (g)
Tentukan pereaksi pembatas.
Mol CaCO3 = 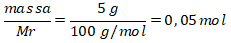
Mol HCl = M x V = 0,5 M x 100 mL = 50 mmol = 0,05 mol
Sehingga, yang menjadi pereaksi pembatas adalah HCl. Pereaksi pembatas adalah zat yang memiliki  paling kecil.
paling kecil.
Persamaan reaksi:
CaCO3 (s) + 2HCl (aq) -> CaCl2 (aq) + H2O (g) + CO2 (g)
Mula – mula 0,05 0,05 – –
Reaksi 0,025 0,05 0,025 0,025 0,025
Sisa 0,025 – 0,025 0,025 0,025
Ingat! Perbandingan mol = perbandingan koefisien.
Mol CO2 = 0,025 mol.
Pada keadaan suhu kamar atau RTP (Room temperature Preasure) berlaku:
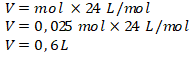

Topik : Teori dan Karakteristik Asam dan Basa
Subtopik : Teori Asam-Basa Bronsted-Lowry
Level : HOTS
5. Perhatikan reaksi berikut ini!
- HF + H2O -> F– + H3O+
- NH3+ H2O -> NH4+ + OH–
- C6H5COOH + H2O -> C6H5COO– + H3O+
- RNH2+ H2O -> RNH3 + OH–
Air merupakan salah satu zat yang bersifat amfoter, artinya dapat bertindak sebagai asam maupun basa. Reaksi yang menunjukkan air bertindak sebagai basa adalah ….
- 1, 2, dan 3
- 1 dan 3
- 2 dan 4
- 4 saja
- 1, 2, 3, 4
Jawaban: B
Pembahasan:
Asam Basa Bronsetd-Lowry adalah pasangan asam basa yang hanya berbeda pada satu atom H saja. Asam memiliki atom H lebih banyak dibandingkan basa.
Pada reaksi (1) HF + H2O -> F– + H3O+
H2O berpasangan dengan H3O+, H2O memiliki atom H 1 lebih sedikit dibandingkan H3O+ sehingga H2O pada reaksi ini bertindak sebagai basa.
Pada reaksi (3) C6H5COOH + H2O -> C6H5COO– + H3O+
H2O berpasangan dengan H3O+, H2O memiliki atom H 1 lebih sedikit dibandingkan H3O+ sehingga H2O pada reaksi ini bertindak sebagai basa.

Topik : Titrasi
Subtopik : Konsep Titrasi Asam Basa
Level : HOTS
6. Seorang siswa mengencerkan sebanyak 5 mL H2SO4 pekat hingga volume nya mencapai 500 mL. Kemudian 25 mL larutan hasil pengenceran tersebut tepat dinetralkan dengan 50 mL NaOH 0,15 M. Konsentrasi asam pekat tersebut adalah ….
- 7,5 M
- 12,5 M
- 15 M
- 17 M
- 18 M
Jawaban: C
Pembahasan:
Gunakan rumus titrasi untuk mengetahui konsentrasi H2SO4 hasil pengenceran:
Ma . Va . a = Mb . Vb . b
Ma . 25 mL . 2 = 0,15 M . 50 mL . 1
Ma = 0,15 M
Gunakan rumus pengenceran untuk mengetahui konsentrasi H2SO4 pekat:
M1 . V1 = M2 . V2
M1 . 5 mL = 0,15 M . 500 mL
M1 = 15 M

Topik : Larutan Penyangga
Subtopik : Konsep Penyangga
Level : LOTS
7. Larutan penyangga adalah larutan yang dapat mempertahankan pH. Di dalam darah manusia terdapat sistem penyangga yang dapat menjaga pH darah selalu stabil, sistem penyangga tersebut adalah ….
- H3PO4dan H2PO4–
- HCO3–dan CO32-
- HPO42-dan H2PO4–
- H2CO3dan HCO3–
- HPO42-dan PO42-
Jawaban: D
Pembahasan:
Sistem penyangga dalam darah berfungsi untuk menjaga pH darah agar selalu stabil. Sistem penyangga yang terdapat dalam darah adalah H2CO3 dan HCO3–.
Sedangkan, HPO42- dan H2PO4– merupakan sistem penyangga dalam cairan sel tubuh.

Topik : Keseimbangan Ion dan pH larutan garam (Hidrolisis)
Subtopik : Penentuan pH garam
Level : HOTS
8. Seorang siswa memiliki beberapa jenis garam yang berbeda. Garam – garam tersebut dilarutkan dalam air kemudian diuji menggunakan indikator kertas lakmus. Garam yang dapat mengubah warna lakmus merah menjadi biru adalah ….
- amonium klorida
- barium nitrat
- natrium asetat
- kalium sulfat
- kalium bromida
Jawaban: C
Pembahasan:
Garam jika dilarutkan dalam air maka akan mengalami reaksi hidrolisis. Reaksi hidrolisis garam terbagi menjadi:
- Hidrolisis sebagian — merupakan garam yang berasal dari asam lemah dengan basa kuat (garam basa) dan garam yang berasal dari asam kuat dan basa lemah (garam asam)
- Hidrolisis sempurna — merupakan garam yang berasal dari asam dan basa lemah
- Tidak terhidrolisis — merupakan garam yang berasal dari asam dan basa kuat
Garam yang dapat mengubah warna lakmus merah menjadi biru adalah garam yang bersifat basa, yaitu garam yang berasal dari asam lemah dan basa kuat atau garam yang berasal dari asam lemah dan basa kuat dengan nilai Kb > Ka.
- amonium klorida — berasal dari amonium hidroksida (basa lemah) dan asam klorida (asam kuat) — garam asam
- barium nitrat — berasal dari barium hidroksida (basa kuat) dan asam nitrat (asam kuat) — garam netral
- natrium asetat — berasal dari natrium hidroksida (basa kuat) dan asam asetat (asam lemah) — garam basa
- kalium sulfat — berasal dari kalium hidroksida (basa kuat) dan asam sulfat (asam kuat) — garam netral
- kalium bromida — berasal dari kalium hidroksida (basa kuat) dan asam bromida (asam kuat) — garam netral

Topik : Termokimia
Subtopik : Perubahan entalpi standar
Level : HOTS
9. Reaksi pembentukan gas NH3 memiliki persamaan sebagai berikut:
N2 (g) + 3H2 (g) -> 2NH3 (g) 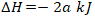
Pernyataan berikut yang tepat adalah ….
- Entalpi reaksi pembentukan standar NH3 = -2a kJ
- Reaksi pembentukan NH3 merupakan reaksi endoterm.
- Reaksi pembentukan standar NH3 akan melepaskan kalor sebanyak a kJ
- Pada pembentukan 1 mol NH3 dibutuhkan kalor sebanyak 2a kJ.
- Pada reaksi pembentukan standar NH3 sebanyak a kJ kalor mengalir dari lingkungan ke sistem
Jawaban: C
Pembahasan:
Reaksi tersebut merupakan reaksi eksoterm, karena entalpi bertanda negatif.
Pada reaksi eksoterm terjadi perpindahan kalor dari sistem ke lingkungan karena kalor dilepas dari sistem.
Pembentukan 1 mol NH3 akan melepaskan kalor sebanyak a kJ.
Ingat! Entalpi standar merupakan entalpi untuk pembentukan 1 mol senyawa.

Topik : Laju Reaksi
Subtopik : Faktor – faktor yang memengaruhi laju reaksi
Level : HOTS
10. Seorang siswa melakukan percobaan kinetika kimia dengan mereaksikan sejumlah zat. Variabel bebas dari reaksi tersebut adalah konsentrasi zat dan variabel terikat adalah laju reaksi. Setelah akhir percobaan ternyata laju reaksi meningkat pada konsentrasi yang lebih tinggi, fenomena ini dapat dijelaskan karena kenaikan konsentrasi akan ….
- memperbesar suhu reaksi
- memperbesar energi aktivasi
- memperbesar tekanan
- memperbesar energi kinetik molekul reaktan
- meningkatan frekuensi tumbukan efektif
Jawaban: E
Pembahasan:
Salah satu faktor yang mempengaruhi laju reaksi adalah konsentrasi. Makin tinggi konsentrasi, frekuensi terjadinya tumbukan akan makin banyak terjadi sehingga laju reaksi semakin besar.

Topik : Kesetimbangan Kimia
Subtopik : Pergeseran kesetimbangan dan Faktor-faktor yang mempengaruhi pergeseran kesetimbangan kimia
Level : HOTS
11. Pada sistem kesetimbangan 2NH3 N2 + 3H2 ∆H = -x kkal. Agar kesetimbangan bergeser ke arah pembentukan gas hidrogen dilakukan dengan ….
- Memperkecil tekanan dan menaikkan suhu
- Memperbesar tekanan dan menurunkan suhu
- Menambah katalis dan menaikkan suhu
- Memperbesar tekanan dan suhu tetap
- Memperkecil volume dan suhu tetap
Jawaban: A
Pembahasan:
Faktor – faktor yang mempengaruhi kesetimbangan:
- Jika suhu dinaikkan maka kesetimbangan akan bergeser ke arah reaksi endoterm, sebaliknya jika suhu diturunkan maka kesetimbangan akan bergeser ke arah reaksi eksoterm.
- Tekanan dan volume. Tekanan berbanding terbalik dengan volume, jika tekanan diperbesar maka volume diperkecil sehingga kesetimbangan akan bergeser ke arah koefisien kecil
- Jika konsentrasi produk ditambahkan, maka kesetimbangan akan bergeser ke arah reaktan. Jika konsentrasi produk dikurangi, maka kesetimbangan akan bergeser ke arah produk.
Kesetimbangan akan bergeser ke arah pembentukan produk (gas klor) jika:
- Suhu dinaikkan, karena reaksi yang terjadi merupakan reaksi endoterm
- Tekanan diperkecil.
- Volume diperbesar
Sehingga jawaban yang tepat adalah menaikkan suhu dan memperkecil tekanan.

Topik : Sifat Koligatif Larutan
Subtopik : Aplikasi Sifat Koligatif Larutan
Level : LOTS
12. Berikut ini yang merupakan aplikasi sifat koligatif larutan penurunan titik beku dalam kehidupan sehari-hari adalah ….
- Hemodialisa (cuci darah)
- Membunuh lintah dengan garam
- Mencairkan salju di jalan dengan penambahan etilen glikol
- Menambahkan urea dalam radiator mobil
- Menambahkan garam saat merebus daging
Jawaban: C
Pembahasan:
Hemodialisa (cuci darah) – tekanan osmotik
Membunuh lintah dengan garam – tekanan osmotik
Mencairkan salju di jalan dengan penambahan etilen glikol – penurunan titik beku
Menambahkan urea dalam radiator mobil – kenaikan titik didih
Menambahkan garam saat merebus daging – kenaikan titik didih

Topik : Redoks dan Sel Elektrokimia
Subtopik : Hukum Faraday
Level : HOTS
13. Logam Natrium dapat diperoleh dengan cara mengelektrolisis lelehan NaCl menggunakan elektroda inert, massa logam Natrium yang dihasilkan di katoda dari elektrolisis lelehan NaCl selama 20 menit dengan kuat arus 5 A adalah sebesar …. (Ar Na = 23 gr/mol; Cl = 35,5 gr/mol)
- 1,43 gr
- 2,35 gr
- 3,75 gr
- 5,23 gr
- 6,44 gr
Jawaban: A
Pembahasan:
Pada elektrolisis lelehan NaCl terjadi reaksi sebagai berikut:
Katoda : Na+ (aq) + e → Na (s)
Perubahan biloks = 1
Massa logam yang diendapkan di katoda adalah logam Na:
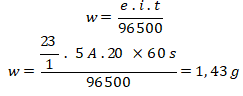

Topik : Senyawa Turunan Alkana
Subtopik : Identifikasi Aldehid dan Keton
Level : HOTS
14. Suatu senyawa karbon, X memiliki rumus molekul C4H8O. Senyawa X dapat bereaksi dengan pereaksi fehling membentuk endapan merah bata. Jika senyawa X bereaksi dengan gas hidrogen akan menghasilkan senyawa Y. Senyawa Y adalah ….
- Butanon
- 1-butanol
- 2-butanol
- Asam butanoat
- Butanal
Jawaban: B
Pembahasan:
C4H8O merupakan rumus molekul untuk suatu aldehid atau keton.
Aldehid direaksikan dengan fehling akan menghasilkan endapan merah bata, sedangkan keton tidak. Karena senyawa X dapat bereaksi dengan fehling, maka senyawa X merupakan aldehid.
Aldehid jika direaksikan dengan gas hidrogen akan mengalami reaksi reduksi dan menghasilkan alkohol primer.
Senyawa yang merupakan alkohol primer adalah 1-butanol.

Topik : Hidrokarbon
Subtopik : Alkana
Level : MOTS
15. Senyawa berikut ini yang merupakan isomer dari senyawa 2-metilpentana adalah ….
- 2,3-dimetilbutana
- 2,3-dimetilpropana
- 2,2,3-trimetilbutana
- 2-metilbutana
- 3-metilheptana
Jawaban: A
Pembahasan:
Isomer merupakan senyawa yang memiliki rumus molekul yang sama namun strukturnya berbeda.
2-metilpentana memiliki rumus molekul C6H14.
2,3-dimetilbutana memiliki rumus molekul C6H14.
2,3-dimetilpropana memiliki rumus molekul C5H12.
2,2,3-trimetilbutana memiliki rumus molekul C7H16.
2-metilbutana memiliki rumus molekul C5H12.
3-metilheptana memiliki rumus molekul C7H16.

Topik : Minyak Bumi
Subtopik : Proses Lanjutan Pengolahan Minyak Bumi
Level : LOTS
16. Proses pembersihan dari kontaminasi dengan menambahkan soda kaustik dalam proses pengolahan minyak tanah disebut ….
- reforming
- cracking
- blending
- ekstraksi
- treating
Jawaban: E
Pembahasan:
Pembersihan dari kontaminasi dinamakan proses treating. Pada proses pengolahan tahap pertama dan tahap kedua sering terjadi kontaminasi (pengotoran). Kotoran – kotoran ini harus dibersihkan dengan cara menambahkan soda kaustik (NaOH), tanah liat atau proses hidrogenasi.

Topik : Benzena dan Turunannya
Subtopik : Tata Nama Turunan Benzena
Level : MOTS
17. Perhatikan struktur senyawa berikut ini!
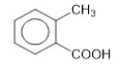
Nama yang tepat untuk senyawa di atas adalah ….
- Asam p-metilbenzoat
- Asam o-metilbenzoat
- Asam m-metilbenzoat
- Asam 3-metilbenzoat
- Asam metilbenzoat
Jawaban: B
Pembahasan:
Tata nama Benzena:
- Benzena pada umumnya dipakai sebagai induk dan gugus yang terikat disebutkan lebih dulu kemudian diikuti dengan benzena.
- Untuk dua subtituen posisinya dapat diberi awalan : orto (o) untuk posisi 1 dan 2, meta (m) untuk posisi 1 dan 3 dan para (p) untuk posisi 1 dan 4.
- Gugus bervalensi satu yang diturunkan dari benzena disebut fenil dan gugus yang diturunkan dari toluene disebut benzil.
- Untuk tiga substituent atau lebih, awalan orto, meta, dan para tidak diterapkan lagi, tetapi posisi substituen yang dinyatakan dengan angka, urutan prioritas penomoran adalah sebagai berikut: –COOH ; –SO3H ; –CHO ; –CN ; –OH ; –NH2; –R ; –NO2 ; –X
- Bila cincin benzena terikat pada rantai alkana bergugus fungsi atau rantai alkana dengan 7 atom karbon atau lebih maka rantai alkana tersebut sebagai induk, sedangkan cincin benzena sebagai substituen.
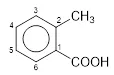
Dari soal dapat diketahui bahwa benzena mengikat gugus –CH3 dan –COOH. Prioritas penomoran dimulai dari atom C yang mengikat gugus –COOH.
Sehingga, nama yang tepat adalah Asam 2-metilbenzoat atau Asam o-metilbenzoat.

Topik : Makromolekul
Subtopik : Protein
Level : HOTS
18. Seorang siswa menguji beberapa jenis makanan yang mengandung protein, yaitu putih telur, susu, tahu, dan ikan. Keempat protein tersebut dilakukan uji biuret, xantoproteat, dan Pb-asetat. Setelah akhir percobaan didapatkan hasil bahwa susu dan tahu hanya dapat bereaksi dengan biuret membentuk warna ungu. Ikan dapat bereaksi dengan biuret dan xantoproteat dengan membentuk warna berturut – turut ungu dan jingga. Putih telur bereaksi dengan ketiga uji tersebut, biuret (ungu), xantoproteat (jingga) dan Pb-asetat (hitam). Berdasarkan data hasil percobaan tersebut, bahan yang diperkirakan mengandung protein dengan unsur belerang adalah ….
- putih telur
- susu dan ikan
- susu dan tahu
- putih telur dan ikan
- tahu dan ikan
Jawaban: A
Pembahasan:
Jenis Uji protein:
- Uji biuret — hasil positif menunjukkan warna ungu artinya bahan makanan mengandung protein
- Uji xantoproteat — hasil positif menunjukkan warna jingga artinya bahan makanan mengandung inti benzena
- Uji Pb-asetat — hasil positif menunjukkan warna hitam artinya bahan makanan mengandung unsur belerang.
Berdasarkan uji protein diatas, bahan makanan yang memberikan hasil positif pada uji Pb-Asetat hanya putih telur.

Topik : Kimia Unsur 1
Subtopik : Alkali
Level : HOTS
19. Seorang siswa melakukan uji nyala terhadap logam natrium dan logam barium. Hasil pengamatannya menunjukkan bahwa logam natrium memancarkan api berwarna kuning, sedangkan logam barium memancarkan api berwarna hijau. Pernyataan yang paling sesuai terkait fenomena ini adalah ….
- panjang gelombang yang dipancarkan barium lebih panjang
- frekuensi logam natrium yang terpancar lebih besar
- pada saat dilakukan pembakaran terjadi eksitasi elektron dari kulit paling tinggi ke kulit paling rendah
- kalor yang didapat dari proses pembakaran akan diserap oleh atom dan menyebabkan elektron tereksitasi
- setelah terjadi pembakaran, elektron yang tereksitasi bersifat tidak stabil dan kembali ke kulit semula dengan menyerap kalor.
Jawaban: D
Pembahasan:
Apabila senyawa kimia dipanaskan maka akan terurai menjadi unsur – unsur penyusunnya dalam bentuk gas. Atom – atom dari unsur tersebut mampu menyerap sejumlah energi tinggi. Atom logam menjadi tidak stabil, sehingga bisa kembali ke tingkat dasar dengan memancarkan energi dalam bentuk cahaya. Masing – masing atom mempunyai energi yang diserap atau dilepaskan yang berbeda – beda. Perbedaan tersebut menyebabkan terjadinya warna – warna yang berbeda sehingga akan memberikan warna – warna yang jelas dan khas untuk setiap atom.
Warna kuning memiliki panjang gelombang lebih besar dibandingkan warna hijau, sebaliknya frekuensi yang terpancar oleh warna hijau lebih besar dibandingkan warna kuning.
Sehingga jawaban yang tepat adalah “kalor yang didapat dari proses pembakaran akan diserap oleh atom dan menyebabkan elektron tereksitasi.

Topik : Kimia Unsur 2
Subtopik : Halogen
Level : MOTS
20. Reksi berikut yang dapat terjadi dalam keadaan standar adalah ….
- Larutan KBr dengan gas I2
- Larutan KCl dengan gas I2
- Larutan MgCl2 dengan gas Br2
- Larutan MgF2 dengan gas Cl2
- Larutan KI dengan gas Br2
Jawaban: E
Pembahasan:
Pada reaksi antar unsur – unsur halogen, reaksi yang dapat berlangsung jika unsur yang letaknya lebih atas dalam sistem periodik unsur mendesak ion unsur dibawahnya, tetapi jika yang terjadi sebaliknya maka reaksi tidak dapat berlangsung.
Urutan unsur golongan halogen dari atas ke bawah adalah F, Cl, Br, I.
Oksidator terkuat adalah F, sedangkan reduktor terkuat adalah I.
Dalam sistem periodik unsur, unsur-unsur dalam satu golongan dari atas ke bawah sifat oksidatornya semakin kecil.
Sehingga reaksi yang dapat berlangsung spontan adalah reaksi antara larutan KI dengan gas Br2, karena I dapat mereduksi Br menjadi Br2.

Mudah dipahami ‘kan penjelasan dari soal-soal di atas? Semoga beberapa latihan soal tadi bisa membantu kamu dalam mengerjakan soal-soal UNBK nanti ya. Masih mau latihan soal lainnya? Jangan lupa terus buka ruangbaca atau kamu juga bisa melihat ribuan latihan soal di ruangbelajar.