Pengertian Gas Ideal, Sifat, Hukum & Persamaannya | Fisika Kelas 11

Yuk, kenal lebih dekat tentang gas ideal! Apa itu gas ideal? Seperti apa sifat-sifat dan persamaannya? Pelajari selengkapnya dalam artikel Fisika kelas 11 berikut, ya!
—
Teman-teman, pernah nggak mendengar istilah gas sejati dan gas ideal?
Gas sejati adalah gas nyata yang ada di sekitar kita. Contohnya, gas yang kita hirup, gas yang keluar dari kendaraan bermotor, dan sebagainya. Gas sejati memiliki sifat dan interaksi yang sangat kompleks.
Sementara itu, gas ideal adalah gas teoretik yang digunakan untuk mempelajari perilaku gas. Karena gas sejati bersifat kompleks, maka susah bagi kita untuk mempelajari perilakunya.
Oleh karena itu, gas sejati ini disederhanakan menjadi gas ideal. Karena telah disederhanakan, gas ideal pun memiliki sifat dan interaksi yang lebih sederhana dibandingkan gas sejati. Jadi, sederhananya, gas ideal adalah model untuk perhitungan perilaku gas sejati atau gas nyata.
Sifat-Sifat Gas Ideal
Salah satu sifat pada gas ideal adalah partikel-partikelnya tidak memiliki volume dan gaya antar partikelnya diabaikan, kecuali tumbukan.
Gas-gas nyata, seperti gas O2, H2, CO2, dan gas lainnya, dapat mendekati sifat gas ideal ketika berada pada temperatur tinggi dan bertekanan rendah.
Sifat lain yang dimiliki gas ideal, yakni jarak antarmolekulnya sangat jauh jika dibandingkan dengan ukuran molekulnya sendiri. Selain itu, partikel gas ideal bergerak dengan acak dan bertumbukan lenting sempurna, baik dengan dinding wadah gas atau dengan partikel gas lainnya.
Baca Juga: Pengertian, Penerapan, Rumus, dan Contoh Soal Kapilaritas
Konsep Mol pada Gas Ideal
Untuk menyatakan banyaknya zat pada gas ini, digunakan sebuah besaran yang kita sebut sebagai jumlah zat dengan satuan standar internasionalnya adalah mol. Dalam 1 mol zat sendiri terdapat 6,022 × 1023 partikel yang terkandung di dalamnya.

Contoh Soal!
Pada suhu dan tekanan massa dari 1 liter gas A adalah seperempat dari massa 1 liter gas SO3. Tentukan massa molekul relatif gas A tersebut! (Ar O = 16, S = 32)
Pembahasan:
Sebelum mencari massa molekul relatif gas A, kita cari dulu massa molekul relatif gas SO3.
Mr SO3 = (1 × Ar S) + (3 × Ar O)
Mr SO3 = (1 × 32) + (3 × 16)
Mr SO3 = 80
Nah, diketahui pada soal kalau massa 1 liter gas A adalah ¼ dari massa 1 liter gas SO3, sehingga:
Massa A = ¼ Massa SO3
mol × Mr A = ¼ × mol × Mr SO3
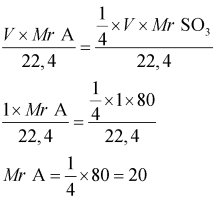
Jadi, massa molekul relatif gas A yaitu 20 kg/mol.
Hukum dan Persamaan Gas Ideal
Pada teori kinetik gas, keadaan gas diuji oleh beberapa ilmuwan dan menghasilkan beberapa temuan sebagai berikut:
1. Hukum Boyle
Hukum Boyle menyatakan bahwa tekanan gas berbanding terbalik dengan volume gas, saat temperatur dan jumlah zat gas dijaga tetap konstan. Secara matematis, hal tersebut dapat dituliskan seperti berikut:
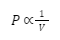
Atau dalam bentuk lain, bisa dituliskan seperti berikut:
PV = konstan
Sehingga, untuk persamaan perbandingan keadaan gas sesuai hukum Boyle, bisa dituliskan seperti berikut:

Contoh Soal:
Diketahui pada awalnya, jumlah suatu gas ideal memiliki tekanan sejumlah P dan volume sejumlah V. Kemudian, tekanan gas tersebut berubah menjadi 4 kali tekanan awal. Berapakah volume gas tersebut sekarang?
Pembahasan:
P1 . V1 = P2 . V2
P2 = 4P1 , sehingga
P1 . V1 = 4P1 . V2
V1 = 4V2
V2 = ¼ V1
Jadi, volume gas tersebut sekarang menjadi ¼ volume gas awal.
2. Hukum Charles
Hukum Charles, menyatakan bahwa temperatur mutlak dan volume gas akan berbanding lurus saat tekanan dan jumlah zatnya dijaga tetap. Secara matematis, hal tersebut bisa dituliskan seperti ini:
V ∝ T
Dalam bentuk lain, bisa juga dituliskan seperti ini:
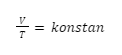
Sehingga, hubungan keadaan awal dan keadaan akhirnya, bisa ditulis seperti rumus berikut ini:

Contoh Soal:
Diketahui sebuah gas ideal memiliki volume awal sebesar ½V, dengan volume akhir sebesar 2V. Sementara itu, gas tersebut memiliki suhu sebesar T. Berapakah besar suhu akhir dari gas tersebut?
Pembahasan:
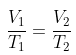
V1 = ½V
V2 = 2V
T1 = T
Ditanya: T2 …?
V1 / T1 = V2 / T2
½V / T = 2V / T2
T2 = 4T
Jadi, suhu akhir gas tersebut adalah sebesar 4 kali dari suhu awal.
3. Hukum Gay-Lussac
Hukum Gay-Lussac menyatakan bahwa tekanan pada gas berbanding lurus dengan temperatur mutlaknya, saat gas dijaga dalam volume dan jumlah zat yang tetap. Secara matematis, hal tersebut dapat dituliskan seperti ini:
P ∝ T
Dalam bentuk lain, bisa dituliskan juga seperti ini:
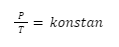
Kemudian, untuk perbandingan keadaan awal dan keadaan akhirnya, bisa dituliskan seperti pada rumus berikut:

Nah, hubungan ketiga besaran makroskopik tersebut, yang terdiri atas tekanan (P), volume (V), dan temperatur (T), bisa dinyatakan dalam hukum gabungan gas ideal, di mana syaratnya adalah jumlah zat harus dalam keadaan konstan.
Secara matematis, hal tersebut dapat dituliskan seperti rumus berikut:
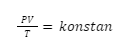
Untuk persamaan keadaan awal dan akhirnya dapat ditulis dengan rumus seperti berikut:
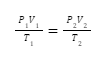
Contoh Soal:
Diketahui sebuah gas ideal memiliki tekanan awal sejumlah P, sementara suhu awalnya adalah T. Kemudian, gas tersebut mengalami perubahan tekanan menjadi 3P. Berapa suhu gas tersebut sekarang?
Pembahasan:
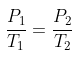
P1 = P
P2 = 3P
T1 = T
Ditanya: T2 …?
P1 / T1 = P2 / T2
P / T = 3P / T2
T2 = 6T
Jadi, suhu gas tersebut sekarang berubah menjadi 6T.
—
Nah, sudah paham kan dengan materi hukum dan persamaan gas ideal? Atau masih penasaran? Kalau masih penasaran, yuk pelajari selengkapnya di ruangbelajar! Daftarkan dirimu sekarang juga, ya!
















