Latihan Soal UTBK SBMPTN 2021: Kimia

Sudah sejauh mana persiapanmu untuk menghadapi UTBK 2021? Berikut adalah latihan soal TKA UTBK 2021 mata pelajaran Kimia. Selamat berlatih!
—

Topik: Kesetimbangan dan Laju Reaksi Kimia (NEW!)
Subtopik: Soal Konstanta dan Pergeseran Kesetimbangan
Konsep: Pengaruh suhu terhadap pergeseran kesetimbangan || Pengaruh tekanan terhadap pergeseran kesetimbangan || Faktor-faktor pergeseran kesetimbangan || Pengaruh volume terhadap pergeseran kesetimbangan || Pengaruh konsentrasi terhadap pergeseran kesetimbangan.
1. NH3 mengalami disosiasi menjadi N2 dan H2 dalam wadah 1 L sesuai dengan reaksi berikut.
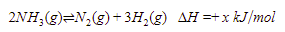
Pada temperatur tertentu, konsentrasi gas pada kesetimbangan masing-masing adalah 0,1 M, maka kesetimbangan reaksi tersebut ….
- tidak bergeser ketika tekanan diperbesar
- bergeser ke kanan ketika volume diperkecil
- bergeser ke kiri ketika tekanan diperkecil
- bergeser ke kiri ketika suhu diturunkan
- bergeser ke kiri ketika konsentrasi reaktan diperbanyak
Jawaban: D
Pembahasan:
Ingat! Volume berbanding terbalik dengan tekanan.
Aturan pergeseran kesetimbangan kimia:
- Ketika volume diperkecil dan tekanan diperbesar, kesetimbangan agar bergeser ke jumlah koefisien terkecil.
- Ketika volume diperbesar dan tekanan diperkecil, kesetimbangan agar bergeser ke jumlah koefisien terbesar.
- Ketika suhu dinaikkan, kesetimbangan akan bergeser ke arah reaksi endoterm, sebaliknya ketika suhu diturunkan, kesetimbangan akan bergeser ke arah reaksi eksoterm.
- Ketika salah satu sisi ditambahkan konsentrasinya, maka kesetimbangan akan bergeser ke sisi yang lainnya.
Alasan:
- Reaksi penguraian amonia di atas, memiliki jumlah koefisien reaktan < jumlah koefisien produk, sehingga perubahan volume dan tekanan akan menggeser kesetimbangan.
- Reaksi penguraian amonia terjadi dalam reaksi endoterm (entalpi bernilai positif), maka reaksi akan bergeser ke kanan (menuju arah endoterm) jika suhu dinaikkan. Lalu, reaksi akan bergeser ke kiri (menuju arah eksoterm) jika suhu diturunkan.
Jadi, jawaban yang tepat adalah D.

Topik: Kesetimbangan dan Laju Reaksi Kimia (NEW!)
Subtopik: Soal Laju Reaksi dan Faktor yang Mempengaruhi.
Konsep: Waktu Paruh.
2. Perhatikan persamaan reaksi di bawah ini!
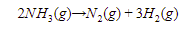
Jika sebanyak 1 M NH3 terurai dalam sebuah wadah 1 L dengan waktu paruh 5 menit, volume gas hidrogen yang terbentuk setelah reaksi berjalan selama 10 menit pada suhu dan tekanan di mana 1 mol gas oksigen bervolume 10 L adalah ….
- 8,75 L
- 11,25 L
- 15,5 L
- 18,25 L
- 20,50 L
Jawaban: B
Pembahasan:
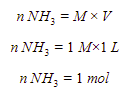


Jadi, jawaban yang tepat adalah B.

Topik: Reaksi Redoks dan Sel Elektrokimia (NEW!)
Subtopik: Soal Sel Elektrolisis
Konsep: Elektroda Larutan dengan Elektroda Tidak Inert
3. Soal terdiri atas 3 bagian, yaitu PERNYATAAN; kata SEBAB; dan ALASAN yang disusun berurutan.
Larutan  0,1 M dielektrolisis menggunakan elektroda Ag dengan kuat arus 2 A selama 10 menit, pada elektroda positif akan terbentuk gas oksigen.
0,1 M dielektrolisis menggunakan elektroda Ag dengan kuat arus 2 A selama 10 menit, pada elektroda positif akan terbentuk gas oksigen.
SEBAB
Setelah akhir elektrolisis pH larutan akan bersifat asam.
Pernyataan yang tepat tentang kedua kalimat di atas adalah …
- Pernyataan benar, alasan benar, dan keduanya menunjukkan hubungan sebab dan akibat.
- Pernyataan benar, alasan benar, tetapi keduanya tidak menunjukkan hubungan sebab dan akibat.
- Pernyataan benar dan alasan salah.
- Pernyataan salah dan alasan benar.
- Pernyataan dan alasan salah
Jawaban: E
Pembahasan:
Persamaan reaksi yang terjadi adalah sebagai berikut.
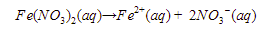
Ion 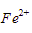 direduksi menjadi logam Fe.
direduksi menjadi logam Fe.
Ion 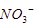 (sisa asam oksi) tidak teroksidasi, yang teroksidasi adalah elektroda Ag karena tidak bersifat inert. Reaksinya menjadi:
(sisa asam oksi) tidak teroksidasi, yang teroksidasi adalah elektroda Ag karena tidak bersifat inert. Reaksinya menjadi:
Katoda: 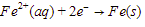
Anoda: 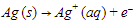
Elektroda positif pada sel elektrolisis adalah anoda. Reaksi yang terjadi di anoda adalah 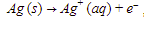 , sehingga yang terbentuk di anoda adalah ion
, sehingga yang terbentuk di anoda adalah ion 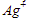 .
.
Setelah akhir elektrolisis, pH tidak berubah karena tidak ada penambahan asam atau basa.
Pernyataan dan alasan salah.
Jadi, jawaban yang tepat adalah E.

Topik: Kimia Organik (NEW!)
Subtopik: Soal Hidrokarbon, Kiralitas dan Isomer
Konsep: Asam Amino Non Esensial || Isomer Optis
4.Berikut adalah struktur asam amino nonesensial.
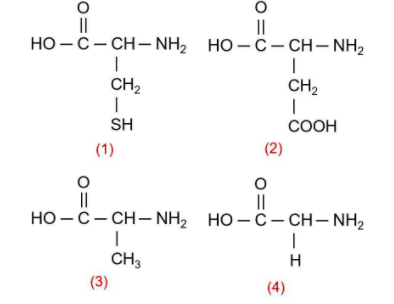
Asam amino yang bersifat optis aktif terdapat pada nomor ….
- (1), (2), dan (3)
- (1) dan (3)
- (2) dan (4)
- (4) saja
- (1), (2), (3), dan (4)
Jawaban: A
Pembahasan:
Suatu zat dikatakan bersifat optis aktif karena dapat memutar bidang polarisasi. Hal ini disebabkan zat tersebut mengandung atom C kiral atau atom C asimetris, yaitu atom C yang mengikat 4 gugus berbeda.
Berdasarkan struktur asam amino di atas, asam amino yang bersifat optis aktif terdapat pada nomor (1), (2), dan (3).
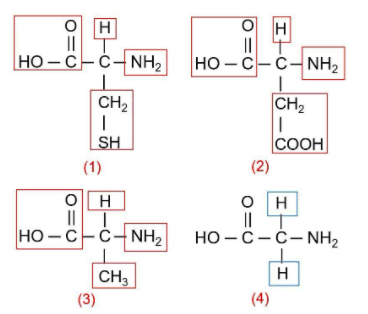
Pada struktur nomor 4, terdapat atom C yang tidak kiral karena mengikat gugus yang sama, yaitu atom H di sisi atas dan bawah.
Jadi, jawaban yang tepat adalah A.

Topik: Larutan dan Kesetimbangannya (NEW!)
Subtopik: Soal Kelarutan dan Sifat Koligatif Larutan
Konsep: Pengaruh Ksp terhadap pengendapan
5. Pada temperatur tertentu, diketahui Ksp 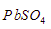 dan PbS secara berurutan adalah
dan PbS secara berurutan adalah 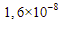 dan
dan 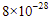 . Pada temperatur tersebut, pernyataan yang benar adalah ….
. Pada temperatur tersebut, pernyataan yang benar adalah ….
- kelarutan
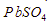 lebih besar daripada kelarutan PbS
lebih besar daripada kelarutan PbS - kelarutan PbS lebih besar daripada kelarutan
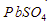
- PbS lebih mudah larut dibandingkan
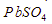
- diperlukan lebih banyak
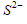 daripada
daripada 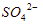 untuk mengendapkan
untuk mengendapkan 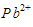 dari dalam larutan.
dari dalam larutan. - kelarutan
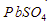 sama dengan kelarutan PbS
sama dengan kelarutan PbS
Jawaban: A
Pembahasan:
Menentukan kelarutan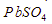
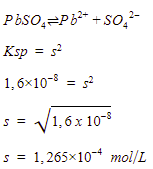
Menentukan kelarutan PbS
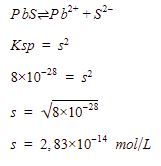
Kelarutan 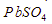 dibanding kelarutan PbS
dibanding kelarutan PbS
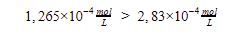
Jadi, jawaban yang tepat adalah A.

Topik: Atom, Molekul dan Interaksinya (NEW!)
Subtopik: Soal Ikatan Kimia, Bentuk Molekul dan Gaya Antarmolekul
Konsep: Hibridisasi Ion Kompleks || Geometri Senyawa Ion Kompleks
6. Logam perak dengan nomor atom 47 dapat berikatan dengan ligan kuat NH3 membentuk ion kompleks [Ag(NH3)2]+. Geometri dari ion kompleks [Ag(NH3)2]+ adalah ….
- Linear
- segitiga planar
- segiempat planar
- tetrahedral
- oktahedral
Jawaban: A
Pembahasan:
Pada hibridisasi ion kompleks, atom pusat harus menyiapkan orbital kosong yang akan ditempati oleh pasangan elektron bebas dari ligan. Pada ion atom 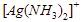 pusatnya adalah Ag dengan nomor atom 47 dan ion kompleks ligannya adalah
pusatnya adalah Ag dengan nomor atom 47 dan ion kompleks ligannya adalah ![]()
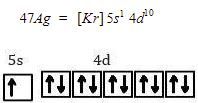
Konfigurasi elektron dan diagram orbital dari Ag, yaitu sebagai berikut.
Muatan ligan ![]() adalah 0, maka
adalah 0, maka
Muatan ion kompleks = muatan ligan + biloks atom pusat+1 = 2 × biloks NH3 + biloks Ag+1 = 2 × 0 + biloks Ag +1 = biloks Ag
Karena ion pusatnya adalah ion Ag+ (melepaskan 1 elektron), maka konfigurasi elektron dan diagram orbitalnya, yaitu sebagai berikut.
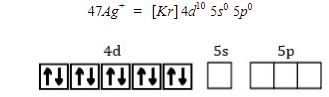
Pada ion kompleks 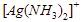 , ion
, ion akan menerima 2 pasang elektron bebas dari
![]() . Oleh karena itu, Ag+ (sebagai ion pusat) harus menyiapkan 2 orbital kosong untuk menerima 2 pasang elektron bebas dari
. Oleh karena itu, Ag+ (sebagai ion pusat) harus menyiapkan 2 orbital kosong untuk menerima 2 pasang elektron bebas dari ![]() (sebagai ligan). 2 orbital kosong tersebut diperoleh dari orbital pada kulit terluar, yaitu kulit ke-5 yang dimulai dari 5s, kemudian 5p.
(sebagai ligan). 2 orbital kosong tersebut diperoleh dari orbital pada kulit terluar, yaitu kulit ke-5 yang dimulai dari 5s, kemudian 5p.
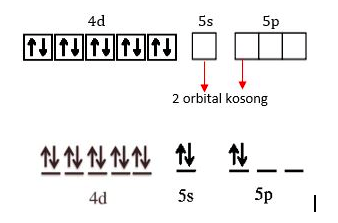
Karena tingkat energi 5s dan 5p berbeda, yaitu tingkat energi 5s lebih rendah dari tingkat energi 5p, maka nantinya akan terjadi proses hibridisasi, sehingga akan membentuk orbital hibrida sp yang memiliki geometri linear.
Jadi, jawaban yang tepat adalah A.

Topik: Kesetimbangan dan Laju Reaksi Kimia (NEW!)
Subtopik: Soal Laju Reaksi dan Faktor yang Mempengaruhi
Konsep: Reaksi Orde 0 || Pengaruh Konsentrasi Terhadap Laju Reaksi || Konstanta Laju Reaksi
7. Pada reaksi 2R G, diketahui memiliki konstanta laju sebesar 1,5 M/s. Pernyataan yang tepat mengenai reaksi tersebut adalah ….
- laju reaksi tersebut dipengaruhi oleh konsentrasi
- reaksi tersebut berorde nol
- jika konsentrasi R dinaikkan dua kali lipat, laju reaksi meningkat 2 kali lebih cepat
- reaksi tersebut memiliki hukum laju
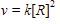
- reaksi tersebut berorde negatif
Jawaban: A
Pembahasan:
Reaksi: 2R G, memiliki persamaan laju: 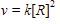 x adalah orde reaksi terhadap R. Satuan laju reaksi (v) adalah M/s atau
x adalah orde reaksi terhadap R. Satuan laju reaksi (v) adalah M/s atau ![]()
Satuan konstanta laju (k) pada reaksi tersebut adalah M/s atau ![]()
Satuan [R] adalah M.
Untuk mencari orde reaksi tersebut, kita masukkan satuan dari v dan k ke persamaan lajunya.
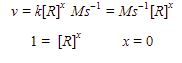
Orde reaksi tersebut adalah 0, maka reaksi tersebut memiliki hukum laju: 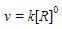 Pada reaksi berorde nol, laju reaksi tidak dipengaruhi oleh konsentrasi.
Pada reaksi berorde nol, laju reaksi tidak dipengaruhi oleh konsentrasi.
Pernyataan yang tepat mengenai reaksi tersebut adalah reaksi tersebut berorde nol.
Jadi, jawaban yang tepat adalah B.

Topik: Benzena dan Turunannya
Subtopik: Reaksi Penting Senyawa Turunan Benzena
Konsep: Gugus Pengarah Meta || Gugus Pengarah Orto dan Para
8. Perhatikan gambar berikut!
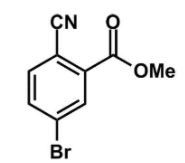
Jika senyawa tersebut dinitrasi, gugus nitro akan masuk ke posisi ….
- 2
- 3
- 4
- 5
- 6
Jawaban: A
Pembahasan:
Gugus yang ada pada gambar adalah gugus ester (-COO-), siano (-CN), dan bromo (-Br). Gugus ester merupakan gugus yang lebih prioritas, sehingga karbon benzena yang mengikatnya menjadi nomor 1 yang pada akhirnya penomorannya seperti berikut.
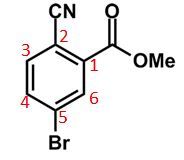
- Gugus ester pengarah meta, sehingga mengarahkan ke nomor 3.
- Gugus siano pengarah meta, sehingga mengarahkan ke nomor 4 dan 6.
- Gugus bromo pengarah orto-para, sehingga mengarahkan ke posisi 4 dan 6.
Posisi 4 dan 6 diarahkan oleh 2 gugus. Pada posisi 6 langsung terapit oleh 2 gugus di posisi 1 dan 5. Posisi 4 lebih “lega” karena posisi 3 kosong sehingga nitro akan cenderung banyak masuk ke posisi 4.
Jadi, jawaban yang benar adalah opsi C.

9. Jika 50 mL larutan 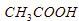 0,4 M
0,4 M 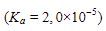 direaksikan dengan larutan
direaksikan dengan larutan 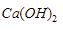 0,2 M memiliki pH = 9, volume larutan
0,2 M memiliki pH = 9, volume larutan 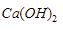 yang digunakan sebanyak ….
yang digunakan sebanyak ….
- 100 mL
- 50 mL
- 40 mL
- 25 mL
- 20 mL
Jawaban: B
Pembahasan:
Garam yang berasal dari asam lemah dan basa kuat bersifat basa sehingga persamaan hidrolisisnya menjadi
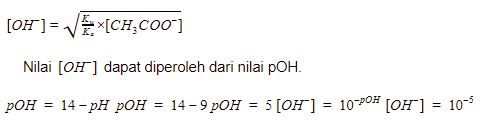
Kembali ke persamaan hidrolisis, kita masukkan data yang telah diketahui.

Volume 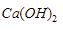 dihitung menggunakan persamaan berikut.
dihitung menggunakan persamaan berikut.
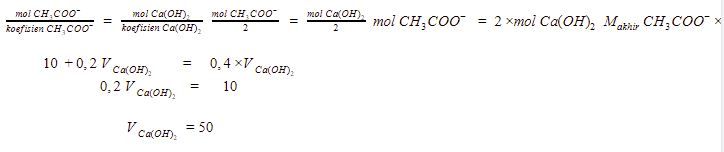
Volume 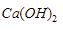 yang digunakan adalah 50 mL.
yang digunakan adalah 50 mL.
Jadi, jawaban yang tepat adalah B.

Topik: Reaksi Redoks
Subtopik: Metode Biloks
Konsep: Reaksi Redoks Molekuler Metode Biloks
10. Asam orto periodik 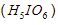 merupakan oksidator menurut reaksi berikut.
merupakan oksidator menurut reaksi berikut.
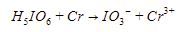
Reaksi tersebut terjadi pada suasana asam. Jika 3 mol asam orto periodik tepat habis bereaksi, jumlah ![]() yang terbentuk sebanyak ….
yang terbentuk sebanyak ….
- 8 mol
- 9 mol
- 10 mol
- 11 mol
- 12 mol
Jawaban: B
Pembahasan:
Penyetaraan reaksi redoks dengan metode biloks dalam suasana asam adalah sebagai berikut.
Langkah 1: menghitung biloks setiap unsur.
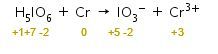
Langkah 2: mengidentifikasi unsur yang mengalami perubahan biloks.
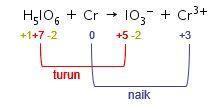
Langkah 3: menyamakan jumlah unsur yang mengalami perubahan biloks, yaitu unsur Mn dan C.
Pada reaksi ini, jumlah atom I dan Cr pada ruas kiri dan kanan sudah sama, yaitu 1 sehingga tidak ada perubahan koefisien.
Langkah 4: menghitung total biloks unsur yang mengalami perubahan biloks dengan cara dikalikan dengan indeks atau koefisien unsur.
Jumlah unsur I dan Cr pada ruas kiri dan kanan adalah 1, maka biloks unsur I dan Cr dikalikan 1.
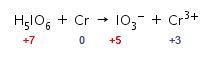
Langkah 5: menghitung total perubahan biloks pada reaksi.
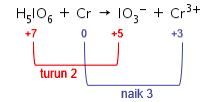
Langkah 6: menyamakan total perubahan biloks pada reaksi.
Kenaikan biloks unsur Cr adalah 3, sedangkan penurunan biloks unsur I adalah 2. Agar total perubahan biloksnya sama, maka cari kelipatan antara 2 dan 3, yaitu 6. Maka, kenaikan biloks unsur Cr dikalikan 2 dan penurunan biloks unsur I dikalikan 2.
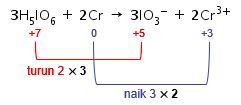
Angka faktor pengali 2 menjadi pengali koefisien dari zat yang mengandung unsur Cr, sedangkan angka faktor pengali 3 menjadi pengali koefisien dari zat yang mengandung unsur I.
Langkah 7: menyamakan jumlah muatan dengan menambah ion H+ pada ruas yang muatannya lebih kecil.
Muatan pada ruas kiri adalah 0, sedangkan muatan pada ruas kanan adalah +3. Maka, tambahkan 3 ion H+ pada ruas kiri sehingga persamaan reaksinya menjadi
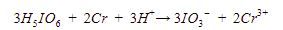
Langkah 8: menyamakan jumlah oksigen dengan menambahkan H2O pada ruas yang kekurangan oksigen.
terdapat 18 atom O pada ruas kiri dan 9 atom O pada ruas kanan. Artinya, di ruas kanan kurang 9 atom O sehingga perlu menambahkan 9 H2O. Persamaan reaksinya menjadi
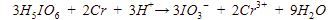
Langkah 9: memeriksa kembali reaksi setara.
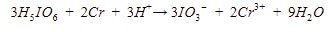
Selanjutnya, kita dapat menghitung mol ![]() yang terbentuk menggunakan perbandingan koefisien.
yang terbentuk menggunakan perbandingan koefisien.
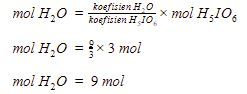
Jadi, jawaban yang tepat adalah B.

Nungguin UTBK 2021 memang bikin cemas. Kuncinya cuma satu: percaya diri! Biar semakin pede sama kemampuanmu, ayo berlatih kumpulan soal try out di ruanguji. Langsung klik banner di bawah ini yaa..
















