Latihan Soal Tryout UTBK 1 Tahun 2021: Kimia

Ayo, persiapkan dirimu sejak dini dalam menghadapi UTBK 2021! Lihat latihan soal tryout UTBK 1 tahun 2021 untuk mata pelajaran Kimia.
—
Sudah mengikuti tyout UTBK 1 dari ruanguji? Nah, masih penasaran mengenai pembahasan soal-soalnya? Yuk, lihat latihan soal tryout UTBK Episode 1 tahun 2021 mata pelajaran Kimia. Jangan lupa untuk mempelajari lagi materi yang belum kamu kuasai ya.

1. Diketahui unsur X terletak pada golongan VA, sedangkan unsur Y terletak pada golongan halogen. Jika kedua unsur berikatan akan membentuk senyawa ![]() Pernyataan yang tepat mengenai molekul adalah ….
Pernyataan yang tepat mengenai molekul adalah ….
- bersifat nonpolar
- memiliki gaya dipol-dipol antar molekulnya
- bentuk molekul bipiramida trigonal
- memiliki sepasang elektron bebas di atom pusatnya
Pilihlah:
- jika jawaban 1, 2, dan 3 benar
- jika jawaban 1 dan 3 benar
- jika jawaban 2 dan 4 benar
- jika jawaban 4 saja yang benar
- jika semua jawaban 1, 2, 3, dan 4 benar
Pembahasan:
Karena unsur X terletak pada golongan VA, maka unsur X memiliki 5 elektron valensi. (Unsur X → VA → elektron valensi : 5)
Karena unsur Y terletak pada golongan VIIA, maka unsur Y memiliki 7 elektron valensi. Unsur Y → halogen (VIIA) → elektron valensi 7.
Struktur lewis dari molekul adalah sebagai berikut.
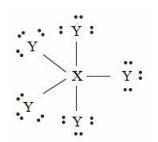
Karena unsur Y memiliki 7 elektron valensi, untuk mencapai kestabilan maka unsur Y membutuhkan 1 elektron lagi yang diperoleh (dipakai bersama) dari unsur X.
Karena unsur X memiliki 5 elektron valensi dan terdapat 5 unsur Y (butuh 1 elektron), maka masing- masing elektron valensi unsur X dipakai bersama untuk berikatan dengan unsur Y.
Dapat disimpulkan:
PEI (pasangan elektron ikatan) = 5
PEB (pasangan elektron bebas pada atom pusat) = 0
Tidak terdapat pasangan elektron bebas di atom pusatnya karena seluruh elektron valensi unsur X sudah habis terpakai untuk berikatan dengan unsur Y.
Berdasarkan jumlah PEI dan PEB, didapatkan tipe molekul 
Karena memiliki tipe molekul ![]() maka bentuk molekulnya adalah bipiramida trigonal.
maka bentuk molekulnya adalah bipiramida trigonal.
Berdasarkan struktur Lewis yang telah kita buat di atas, senyawa tersebut bersifat nonpolar. Sifat nonpolar dari senyawa tersebut dapat kita lihat dari persebaran elektronnya yang sudah merata, tidak terdapat PEB di atom pusat, dan senyawa tersebut simetris.
Karena senyawa tersebut bersifat nonpolar, maka gaya antarmolekul yang terdapat dalam senyawa tersebut adalah gaya London.
Jadi, jawaban yang tepat adalah B.

2. Besi(III) oksida (![]() =160) bereaksi dengan asam sulfat (
=160) bereaksi dengan asam sulfat (![]() = 98) pada suhu tertentu membentuk besi(III) sulfat menurut reaksi berikut.
= 98) pada suhu tertentu membentuk besi(III) sulfat menurut reaksi berikut.
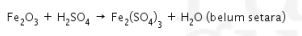
Massa 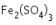 (
(![]() = 400) yang dihasilkan dari reaksi antara 32 g
= 400) yang dihasilkan dari reaksi antara 32 g ![]() dan 300 mL
dan 300 mL ![]() 1 M adalah … gram.
1 M adalah … gram.
- 20
- 40
- 50
- 80
- 90
Pembahasan:
Pertama, setarakan reaksi terlebih dahulu.
Persamaan reaksi:
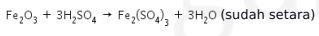
Kita hitung mol ![]() menggunakan persamaan:
menggunakan persamaan:
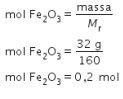
Lalu, kita hitung mol ![]() menggunakan persamaan berikut.
menggunakan persamaan berikut.
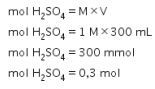
Yang menjadi pereaksi pembatas adalah ![]() karena memiliki mol per koefisien yang paling kecil
karena memiliki mol per koefisien yang paling kecil 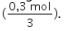

Selanjutnya, menghitung massa 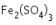 yang dihasilkan menggunakan persamaan sebagai berikut.
yang dihasilkan menggunakan persamaan sebagai berikut.
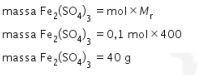
Jadi, jawaban yang tepat adalah opsi B.

3. Perhatikan data nilai energi ikatan rata–rata di bawah ini!
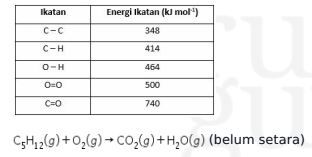
Dari persamaan reaksi tersebut, perubahan entalpi pembakaran 7,2 gram gas 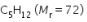 adalah ….
adalah ….
- +131,9 kJ
- -1319 kJ
- +2608 kJ
- -2608 kJ
- -260,8 kJ
Pembahasan:
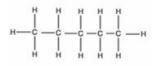
Persamaan reaksi:
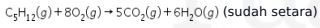
Jika kita jabarkan, menjadi seperti ini:
12 (C-H) + 4 (C-C) + 8 (O=O) → 5 (O=C=O) + 6 (H–O–H)
Karena menggunakan data energi ikatan rata-rata, maka kita dapat menggunakan persamaan:

Jadi, jawaban yang tepat adalah opsi E.

4. Diketahui konfigurasi elektron dari ion ![]() sebagai berikut:
sebagai berikut:
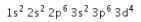
Hal-hal yang tepat mengenai unsur X adalah ….
- Terletak pada periode 3
- Mempunyai 5 elektron tidak berpasangan
- Mempunyai nomor atom 26
- Termasuk golongan transisi
Pilihlah:
- jika jawaban 1, 2, dan 3 benar
- jika jawaban 1 dan 3 benar
- jika jawaban 2 dan 4 benar
- jika jawaban 4 saja yang benar
- jika semua jawaban 1, 2, 3, dan 4 benar
Pembahasan:
Ion ![]() berarti unsur X melepas 3 elektron, sehingga ketika unsur X belum melepas 3 elektron konfigurasinya menjadi:
berarti unsur X melepas 3 elektron, sehingga ketika unsur X belum melepas 3 elektron konfigurasinya menjadi:
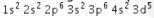
- Periode = jumlah kulit = 4. (Pernyataan 1 SALAH)
Periode juga dapat dilihat pada subkulit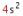 yang menandakan unsur tersebut terletak pada periode 4.
yang menandakan unsur tersebut terletak pada periode 4.
Diagram orbital aturan Hund: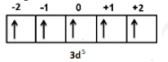
- Dari diagram di atas, ada 5 elektron tidak berpasangan (Pernyataan 2 BENAR).
- Dari konfigurasi dapat kita lihat jumlah elektron dan nomor atomnya:
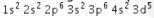 = 2 + 2 + 6 + 2 + 6 + 2 + 5 = 25. (Pernyataan 3 SALAH)
= 2 + 2 + 6 + 2 + 6 + 2 + 5 = 25. (Pernyataan 3 SALAH) - Letak golongan = elektron valensi = 2 + 5 = VIIB. Karena elektron valensi berada pada subkulit s dan d berarti unsur tersebut merupakan golongan transisi (Pernyataan 4 BENAR)
Jadi, jawaban yang tepat adalah opsi C.

5. Senyawa yang bersifat optis aktif adalah ….
- 2-butanol
- 2-propanol
- asam 2-hidroksipropanoat
- 2-butena
Pilihlah:
- jika jawaban 1, 2, dan 3 benar
- jika jawaban 1 dan 3 benar
- jika jawaban 2 dan 4 benar
- jika jawaban 4 saja yang benar
- jika semua jawaban 1, 2, 3, dan 4 benar
Pembahasan:
Senyawa yang bersifat optis aktif dapat memutar bidang polarisasi dan memiliki atom C asimetris (atom C kiral) yaitu atom C yang mengikat empat gugus atom yang berbeda.
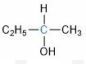
Struktur di atas adalah 2-butanol. Atom C yang berwarna biru mengikat 4 gugus atom yang berbeda yaitu gugus ![]() di kanan, gugus -OH di bawah, gugus
di kanan, gugus -OH di bawah, gugus ![]() di kiri, dan H di atas. Karena memiliki atom C kiral, senyawa tersebut bersifat optis aktif.
di kiri, dan H di atas. Karena memiliki atom C kiral, senyawa tersebut bersifat optis aktif.
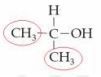
Struktur di atas adalah 2-propanol. Pada senyawa tersebut, tidak ada atom C yang mengikat 4 gugus berbeda. Karena tidak memiliki atom C kiral, senyawa tersebut tidak bersifat optis aktif.
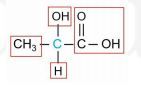
Struktur di atas adalah asam 2-hidroksipropanoat. Atom C yang berwarna biru mengikat 4 gugus atom yang berbeda yaitu gugus -COOH di kanan, -H di bawah, gugus ![]() di kiri, dan gugus -OH di atas. Karena memiliki atom C kiral, senyawa tersebut bersifat optis aktif.
di kiri, dan gugus -OH di atas. Karena memiliki atom C kiral, senyawa tersebut bersifat optis aktif.
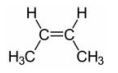
Struktur di atas adalah 2-butena. Pada senyawa tersebut, tidak ada atom C yang mengikat 4 gugus berbeda. Karena tidak memiliki atom C kiral, senyawa tersebut tidak bersifat optis aktif.
Jadi, jawaban yang tepat adalah opsi B.

6. Sebanyak 100 mL ![]() 1 M direaksikan dengan 50 mL HCl 1 M. Jika
1 M direaksikan dengan 50 mL HCl 1 M. Jika 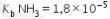 dan log 1,8 = 0,25, pada akhir reaksi larutan akan memiliki pH = 9,25
dan log 1,8 = 0,25, pada akhir reaksi larutan akan memiliki pH = 9,25
SEBAB
larutan tersebut ketika diencerkan sebanyak 10 kali pHnya berkurang 1.
Pilihlah:
- pernyataan benar, alasan benar, keduanya ada hubungan sebab akibat
- pernyataan benar, alasan benar, keduanya tidak ada hubungan sebab akibat
- pernyataan benar dan alasan salah
- pernyataan salah dan alasan benar
- pernyataan dan alasan, keduanya salah
Pembahasan:
Pertama, kita hitung mol ![]() dan HCl terlebih dahulu menggunakan persamaan:
dan HCl terlebih dahulu menggunakan persamaan:

Reaksi kimia:
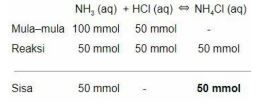
Asam kuat habis bereaksi dan tersisa basa lemah serta larutan garam. Untuk mencari pH gunakan rumus larutan buffer:

100 mL ![]() 0,1 M direaksikan dengan 50 mL HCl 0,1 M. Jika
0,1 M direaksikan dengan 50 mL HCl 0,1 M. Jika 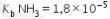 dan log 1,8 = 0,25, pada akhir reaksi larutan akan memiliki pH = 9,25. (Pernyataan BENAR)
dan log 1,8 = 0,25, pada akhir reaksi larutan akan memiliki pH = 9,25. (Pernyataan BENAR)
Karena larutan penyangga fungsinya untuk menyangga pH agar tidak mudah berubah, jadi apabila diencerkan sampai 10 kali perubahan pH nya tidak akan mencapai 1.
Larutan tersebut ketika diencerkan sebanyak 10 kali pHnya berkurang 1. (Alasan SALAH)
Jadi, jawaban yang tepat adalah opsi C.

7. Larutan KBr 1 M dielektrolisis dengan menggunakan elektroda platina selama 30 menit menggunakan arus listrik 1 A. Setelah akhir elektrolisis akan terbentuk ….
- logam kalium di katoda
- bromin di anoda
- gas oksigen di katoda
- pH larutan bersifat basa
Pilihlah:
- jika jawaban 1, 2, dan 3 benar
- jika jawaban 1 dan 3 benar
- jika jawaban 2 dan 4 benar
- jika jawaban 4 saja yang benar
- jika semua jawaban 1, 2, 3, dan 4 benar
Pembahasan:
Elektrolisis larutan KBr dengan elektroda Pt:
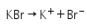
![]() dalam bentuk larutan tidak bereaksi di katoda karena sebagai ion logam alkali potensial reduksinya lebih rendah dari air. Sebagai gantinya, air yang mengalami reduksi di katoda.
dalam bentuk larutan tidak bereaksi di katoda karena sebagai ion logam alkali potensial reduksinya lebih rendah dari air. Sebagai gantinya, air yang mengalami reduksi di katoda.
![]() dapat bereaksi di anoda. Reaksi pada kedua elektroda adalah sebagai berikut.
dapat bereaksi di anoda. Reaksi pada kedua elektroda adalah sebagai berikut.
Katoda : 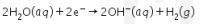
Anoda : 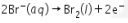
Jadi, jawaban yang tepat adalah terbentuk bromin di anoda (2) dan pH larutan bersifat basa karena di
katoda terbentuk ion hidroksida (4).
Oleh karena itu, jawaban yang benar adalah opsi C.

8. Sebanyak 100 mL ![]() 0,15 M direaksikan dengan 50 mL HCl 0,3 M, pada akhir reaksi larutan akan memiliki pH = 5 (
0,15 M direaksikan dengan 50 mL HCl 0,3 M, pada akhir reaksi larutan akan memiliki pH = 5 (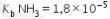 )
)
SEBAB
garam yang terbentuk akan terhidrolisis sempurna dalam air.
Pilihlah:
- pernyataan benar, alasan benar, keduanya ada hubungan sebab akibat
- pernyataan benar, alasan benar, keduanya tidak ada hubungan sebab akibat
- pernyataan benar dan alasan salah
- pernyataan salah dan alasan benar
- pernyataan dan alasan, keduanya salah
Pembahasan:
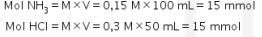
Reaksi kimia yang terjadi sebagai berikut.

Basa lemah dan asam kuat habis bereaksi dan tersisa larutan garam. Untuk mencari pH gunakan rumus hidrolisis garam.
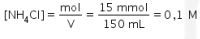
Reaksi ionisasi dan rumus hidrolisis ![]()
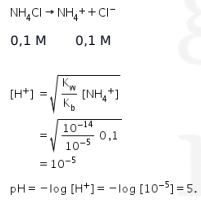
Pernyataan benar.
Garam yang terbentuk adalah garam yang berasal dari asam kuat (HCl) dan basa lemah (![]() ). Hanya salah satu ion (dalam hal ini ion amonium) yang terhidrolisis sehingga mengalami hidrolisis sebagian. Garam yang terhidrolisis sempurna adalah garam yang berasal dari asam lemah dan basa lemah.
). Hanya salah satu ion (dalam hal ini ion amonium) yang terhidrolisis sehingga mengalami hidrolisis sebagian. Garam yang terhidrolisis sempurna adalah garam yang berasal dari asam lemah dan basa lemah.
Alasan salah.
Jadi, jawaban yang benar adalah opsi C.

9. Asam sulfat adalah bahan industri kimia yang penting sebagai bahan baku untuk pembuatan pupuk. Proses pembuatan asam sulfat disebut sebagai proses kontak. Proses kontak menghasilkan asam sulfat mencapai kadar 99% dan biayanya relatif murah. Tahapan yang paling menentukan pada proses kontak adalah tahap kedua, yaitu proses pengubahan ![]() menjadi
menjadi ![]() . Reaksi yang terjadi adalah sebagai berikut.
. Reaksi yang terjadi adalah sebagai berikut.
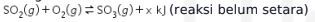
Untuk memperbanyak hasil, cara yang dapat dilakukan adalah ….
- menurunkan tekanan
- memperbesar volume sistem
- memperbanyak katalis
- dilakukan pada suhu rendah
Pilihlah:
- jika jawaban 1, 2, dan 3 benar
- jika jawaban 1 dan 3 benar
- jika jawaban 2 dan 4 benar
- jika jawaban 4 saja yang benar
- jika semua jawaban 1, 2, 3, dan 4 benar
Pembahasan:
Reaksi yang terjadi (setelah setara) adalah 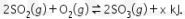
Reaksi menghasilkan energi (reaksi eksoterm) serta koefisien gas produk lebih kecil dari reaktan. Oleh karena itu, produk yang dihasilkan optimal jika hal-hal berikut dilakukan:
- memperbesar tekanan
- memperkecil volume
- dilakukan dalam suhu rendah karena merupakan reaksi eksoterm
- menambahkan jumlah konsentrasi reaktan yang digunakan
Katalis hanya mempercepat terjadinya kesetimbangan namun tidak mempengaruhi pergeseran kesetimbangan.
Jadi, hanya kondisi 4 yang benar, sehingga jawabannya adalah D.

10. Diketahui unsur Xe terletak pada golongan gas mulia, sedangkan O memiliki nomor atom 8. Jika kedua unsur berikatan akan membentuk senyawa ![]() bentuk molekul dari senyawa tersebut adalah ….
bentuk molekul dari senyawa tersebut adalah ….
- bentuk T
- linear
- tetrahedral
- segitiga piramida
- bentuk V
Pembahasan:
Xe → gas mulia → VIIIA → elektron valensi : 8
O → nomor atom 8 → konfigurasi 2 6 → elektron valensi 6
(butuh 2 elektron untuk stabil)
Struktur:
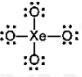
Oleh karena gas mulia sulit bereaksi, reaksi dipaksa dengan tekanan tinggi. Ukuran Xe juga besar sehingga panjang ikatan Xe-O harus pendek, akhirnya membentuk ikatan rangkap meski menyimpang dari aturan oktet.
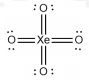
Dapat disimpulkan:
PEI: 4
PEB: 0
Tipe molekul: ![]()
Bentuk molekul: tetrahedral
Jadi, jawaban yang benar adalah opsi C.

11. Perhatikan persamaan reaksi berikut!
![]()
Jika sebanyak 2 M gas ![]() direaksikan dalam sebuah wadah 2 L dengan waktu paruh 3 menit, volume gas oksigen yang terbentuk setelah reaksi berjalan selama 12 menit dalam keadaan STP adalah ….
direaksikan dalam sebuah wadah 2 L dengan waktu paruh 3 menit, volume gas oksigen yang terbentuk setelah reaksi berjalan selama 12 menit dalam keadaan STP adalah ….
- 2,8 L
- 22,4 L
- 28 L
- 42 L
- 44,8 L
Pembahasan:
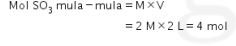
Menentukan mol ![]() yang tersisa dari waktu paruh:
yang tersisa dari waktu paruh:

Untuk menentukan jumlah produk (oksigen) yang terbentuk, kita perlu mengetahui jumlah reaktan yang bereaksi.
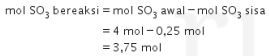
Ingat! Perbandingan koefisien = perbandingan mol.
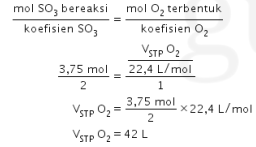
Jadi, jawaban yang benar adalah opsi D.

12. Sejumlah asam sulfat pekat 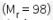 dengan kadar 98% dan massa jenis 1,84 g/mL diencerkan hingga volume nya mencapai 100 mL, kemudian 10 mL larutan tersebut habis bereaksi dengan 25 mL NaOH 0,4 M. Volume asam sulfat yang digunakan sebanyak ….
dengan kadar 98% dan massa jenis 1,84 g/mL diencerkan hingga volume nya mencapai 100 mL, kemudian 10 mL larutan tersebut habis bereaksi dengan 25 mL NaOH 0,4 M. Volume asam sulfat yang digunakan sebanyak ….
- 2,72 mL
- 5,44 mL
- 4,35 mL
- 1,36 mL
- 7,22 mL
Pembahasan:
Pada akhirnya, larutan dilakukan titrasi sehingga kita menggunakan rumus penetralan/titrasi untuk mengetahui konsentrasi asam saat titrasi.
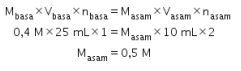
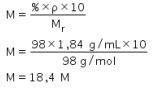
Asam yang digunakan sebelumnya dari konsentrasi pekat yang diencerkan sehingga kita menggunakan rumus pengenceran. Sebelumnya kita harus mencari tahu dulu konsentrasi asam sulfat pekat yang akan digunakan menggunakan persamaan konsentrasi bahan dalam kadar.
Saat pengenceran, jumlah zat terlarut sama sehingga kita menggunakan persamaan kekekalan mol untuk pengenceran.
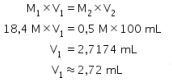
Jadi, jawaban yang benar adalah opsi A.

13. ![]() merupakan basa lemah dengan
merupakan basa lemah dengan 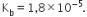 Sebanyak 50 mL
Sebanyak 50 mL ![]() 0,2 M direaksikan dengan 20 mL HCl 0,3 M, kemudian larutan ditambahkan 1 mL HCl 1,5 M. Larutan akhir memiliki pH sebesar ….
0,2 M direaksikan dengan 20 mL HCl 0,3 M, kemudian larutan ditambahkan 1 mL HCl 1,5 M. Larutan akhir memiliki pH sebesar ….

Pembahasan:
Komponen spesi reaksi tahap pertama jumlah molnya adalah sebagai berikut.

Reaksi tahap pertama yang terjadi adalah sebagai berikut.
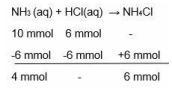
Kemudian ke dalam larutan ditambahkan 1 mL HCl 1,5 M
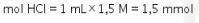
Oleh karena itu, terjadi reaksi tahap kedua sebagai berikut.

Basa lemah tersisa dan terbentuk garamnya, sehingga terbentuk larutan penyangga. Larutan penyangga dengan basa lemah mengikuti persamaan matematis berikut.
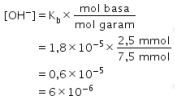
Untuk menentukan pH, mudahnya kita tentukan pOH terlebih dahulu.
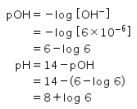
Jadi, jawaban yang benar adalah opsi D.

14. Tetapan penurunan titik beku molal air adalah 0,5. Larutan A dibuat dengan melarutkan 34 g 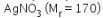 ke dalam 1 L air. Larutan B dibuat dengan melarutkan 24 g urea
ke dalam 1 L air. Larutan B dibuat dengan melarutkan 24 g urea 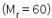 dan 36 g glukosa
dan 36 g glukosa 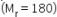 ke dalam 250 g air. Perbandingan
ke dalam 250 g air. Perbandingan ![]() larutan A terhadap
larutan A terhadap ![]() larutan B adalah ….
larutan B adalah ….
- 3/2
- 2/1
- 1/6
- 6/1
- 2/3
Pembahasan:
Larutan A hanya mengandung zat terlarut ![]() sehingga molalitasnya hanya ditentukan zat tersebut.
sehingga molalitasnya hanya ditentukan zat tersebut.
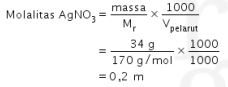
Larutan A mengandung zat terlarut urea dan glukosa yang sama-sama nonelektrolit sehingga molalitasnya gabungan kedua zat tersebut.
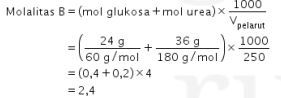
Perbandingan ![]() larutan A dan larutan B dapat ditentukan sebagai berikut.
larutan A dan larutan B dapat ditentukan sebagai berikut.
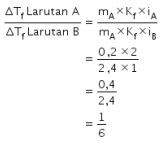
Jadi, jawaban yang benar adalah opsi C.

15. Reaksi kimia berikut yang memiliki nilai Kc sebanding dengan nilai Kp adalah ….
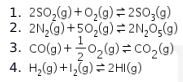
Pilihlah:
- jika jawaban 1, 2, dan 3 benar
- jika jawaban 1 dan 3 benar
- jika jawaban 2 dan 4 benar
- jika jawaban 4 saja yang benar
- jika semua jawaban 1, 2, 3, dan 4 benar
Pembahasan:
Hubungan antara Kc dan Kp dapat dirumuskan sebagai berikut:
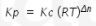
Dimana Δn = koefisien produk – koefisien reaktan.
Nilai Kp akan sama dengan Kc jika Δn = 0 , dimana artinya total koefisien produk = total koefisien reaktan.
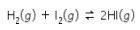
Pada persamaan reaksi keempat, total koefisien produk = total koefisien reaktan = 2. Jadi nilai Kp = Kc.
Jadi, jawaban yang tepat adalah opsi D.

16. Diketahui unsur Berilium memiliki nomor atom 4, sedangkan unsur fluor memiliki nomor atom 9, kedua unsur berikatan membentuk molekul ![]() Pernyataan yang tepat mengenai senyawa
Pernyataan yang tepat mengenai senyawa ![]() adalah ….
adalah ….
- Atom pusat Be memiliki 1 PEB
- Memiliki bentuk molekul linear
- Bentuk molekul segitiga datar
- Terdapat dua ikatan tunggal
Pilihlah:
- jika jawaban 1, 2, dan 3 benar
- jika jawaban 1 dan 3 benar
- jika jawaban 2 dan 4 benar
- jika jawaban 4 saja yang benar
- jika semua jawaban 1, 2, 3, dan 4 benar
Pembahasan:
Konfigurasi Be : 2 2 (terdapat 2 elektron valensi)
Konfigurasi F = 2 7 ( terdapat 7 elektron valensi)
Struktur lewis:

Maka dapat disimpulkan:
- atom pusat Be memiliki 2 PEI (pasangan elektron ikatan) dan 0 PEB,
- tipe molekul
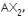
- terdapat 2 ikatan kovalen tunggal, dan
- bentuk molekul adalah linear.
Jadi, jawaban yang tepat adalah opsi C.

17. Perhatikan data potensial reduksi standar berikut!
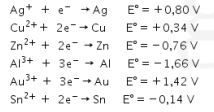
Reaksi yang diharapkan berlangsung spontan adalah ….
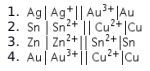
Pilihlah:
- jika jawaban 1, 2, dan 3 benar
- jika jawaban 1 dan 3 benar
- jika jawaban 2 dan 4 benar
- jika jawaban 4 saja yang benar
- jika semua jawaban 1, 2, 3, dan 4 benar
Pembahasan:
Reaksi dapat berlangsung spontan jika ![]() sel nya bernilai positif, sehingga
sel nya bernilai positif, sehingga ![]() reduksi >
reduksi > ![]() oksidasi.
oksidasi.
Reduksi : Penurunan bilangan oksidasi (biloks)
Oksidasi : Kenaikan bilangan oksidasi (biloks)
Kita coba menghitung nilai potensial standar:
Opsi 1: 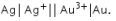
Ingat! [Oksidasi || Reduksi]. Maka,

Reaksi spontan terjadi pada reaksi 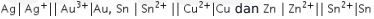 karena
karena ![]() sel reduksi >
sel reduksi > ![]() sel oksidasi.
sel oksidasi.
Reaksi 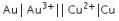 memiliki nilai
memiliki nilai ![]() sel < 0, sehingga tidak berlangsung spontan.
sel < 0, sehingga tidak berlangsung spontan.
Jadi, jawaban yang tepat adalah opsi A.

18. Berikut ini senyawa alkena yang akan menghasilkan dua senyawa propanal pada reaksi ozonisasi adalah ….
- 3-metil-3-heksena
- 3-heksena
- 1-butena
- 2-metil-3-heksena
- 4-oktena
Pembahasan:
Reaksi Ozonisasi merupakan reaksi antara alkena dengan ozon ![]() Reaksi ini merupakan reaksi oksidasi oksidatif yang melibatkan pemutusan ikatan C=C alkena. Reaksi ini bisa menghasilkan produk berupa aldehid dan aldehid, aldehid dan keton, atau keton dan keton, tergantung dari struktur alkena yang digunakan.
Reaksi ini merupakan reaksi oksidasi oksidatif yang melibatkan pemutusan ikatan C=C alkena. Reaksi ini bisa menghasilkan produk berupa aldehid dan aldehid, aldehid dan keton, atau keton dan keton, tergantung dari struktur alkena yang digunakan.
Senyawa alkena yang akan menghasilkan dua senyawa propanal adalah 3-heksena, dengan reaksi sebagai berikut:
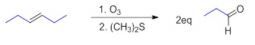
Gugus alkena berada di posisi tengah dengan jumlah atom C di sebelah kiri dan kanan sama banyaknya, sehingga reaksi pemutusannya akan menghasilkan senyawa yang sama.
Jadi, jawaban yang tepat adalah opsi B.

19. Data percobaan reaksi diperoleh dari reaksi: A + B → C sebagai berikut:
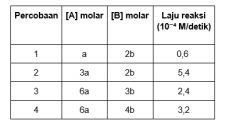
Jika a = 0,03 M dan b = 0,1 M. Maka persamaan laju reaksi dari reaksi di atas adalah ….
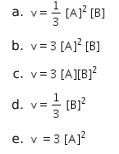
Pembahasan:
Langkah pertama: Menentukan orde reaksi
Persamaan laju reaksi:
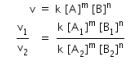
Untuk mencari order m, maka cari nilai [B] yang sama, yaitu pada percobaan 1 dan 2, sehingga persamaannya menjadi:

maka, m = 2.
Untuk mencari order n, maka cari nilai [A] yang sama, yaitu pada percobaan 3 dan 4, sehingga persamaannya menjadi:
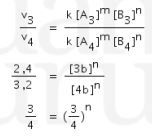 maka n = 1.
maka n = 1.
Persamaan laju reaksi: 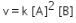
Langkah kedua : Menentukan konstanta laju reaksi
Gunakan salah satu percobaan yang mana saja. Saat ini kita gunakan percobaan 1 dan substitusikan nilai a= 0,03 M dan b=0,1 M:
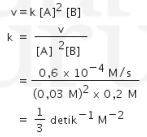
Persamaan laju reaksi menjadi: 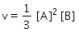
Jadi, jawaban yang tepat adalah opsi A.

UTBK memang masih akan dilaksanakan tahun depan, tapi nggak ada salahnya untuk kamu mencuri start dan mulai mempersiapkan diri sejak dini. Mau mengukur kemampuanmu dalam mengerjakan soal-soal UTBK? Tunggu tryout UTBK Episode 2 dari ruanguji!
















