Latihan dan Pembahasan Soal HOTS SBMPTN: Kimia 2019

Artikel ini memberikan latihan dan pembahasan soal HOTS SBMPTN untuk mata pelajaran Kimia tahun 2019
—
Squad, siap ataupun tidak, sebentar lagi kamu akan menghadapi SBMPTN 2019. Tipe soal HOTS yang banyak dikhawatirkan tentunya harus kamu taklukan dengan kesiapan yang maksimal. Untuk itu, ayo siapkan dirimu dengan latihan dan pembahasan soal HOTS SBMPTN Kimia berikut.

Topik: Atom
Subtopik: Konfigurasi Ion
1. Nomor atom X adalah 26. Konfigurasi elektron ion X3+ adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d3
Sebab
Ion X3+, artinya atom X melepas 3 elektron terluarnya.
Jawaban : D
Pembahasan :
Konfigurasi elektron atom 26X adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Ion X3+, artinya atom X melepas 3 elektron terluarnya, maka elektron yang terlepas dari orbital 4s kemudian 3d.
Sehingga konfigurasi elektron ion 26X3+ adalah 1s2 2s2 2p6 3s2 3p6 4s0 3d5

Topik: Ikatan Kimia
Subtopik: Hibridisasi
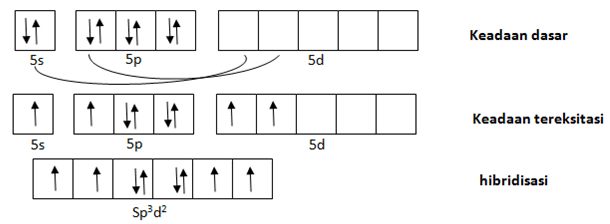
2. Unsur Xe merupakan golongan gas mulia yang sukar berikatan dengan unsur lain. Namun, seiring berkembangnya teknologi, ternyata dapat dibuat senyawa dari unsur Xe dengan unsur paling elektronegatif F yaitu XeF4. Geometri dan tipe hibridisasi pada molekul XeF4 adalah …. (NA Xe:54, F:9)
- Segi empat planar, sp3d2
- Tetrahedron, sp3d
- Segi empat planar, sp2d
- Tetrahedron, sp3
- Bipiramida trigonal, sp3
Jawaban: A
Pembahasan:
Untuk membuat hibridisasi yang dilihat adalah atom pusat. Pada senyawa XeF4 yang menjadi atom pusat adalah Xe.
Konfigurasi elektron 54Xe = [Kr] 5s2 4d10 5p6

Topik: Stokiometri
Subtopik: Stokiometri
3. Suatu cuplikan hanya mengandung unsur nitrogen dan oksigen. Bila dalam 152 gram cuplikan terdapat 56 gram nitrogen, maka rumus empiris senyawa tersebut adalah ….
(ArN:14, O:16)
- N2O5
- N2O3
- N2O
- NO2
- NO
Jawaban: B
Pembahasan:
Cuplikan mengandung N dan O saja.
Massa cuplikan 152 gram
Massa nitrogen 56 gram.
Massa oksigen = 152 gram – 56 gram = 96 gram
Rumus empiris dari perbandingan terkecil mol atom N dan O yaitu
mol N : mol O = 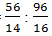
= 4 : 6
= 2 : 3

Topik: Larutan
Subtopik: Asam Kuat
4. Bila larutan asam kuat H2SO4 dengan pH =1 diencerkan 100 kali, maka pH larutan menjadi 3.
Sebab
Jumlah ion H+ dalam larutan berubah bila larutan diencerkan.
Jawaban: A
Pembahasan:
asam kuat H2SO4 dengan pH =1
[H+] = 10-1
[H+] = a Ma , Ma = 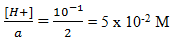
Dilakukan pengenceran 100 kali, misal V1 = 1 ml maka V2 = 100 ml
Maka M2 menjadi
M1 V1 = M2 V2
M2 = 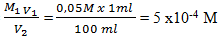
pH setelah pengenceran
[H+] = a Ma
[H+] = 2 x 5 x10-4 = 10-3
pH = -log 10-3 = 3
jadi pernyataan larutan asam kuat H2SO4 dengan pH =1 diencerkan 100 kali, maka pH larutan menjadi 3 itu benar. Alasannya, Jumlah ion H+ dalam larutan berubah menjadi sedikit bila larutan diencerkan.

Topik: Stokiometri
Subtopik: Persamaan Gas Ideal
5. Sebanyak 4,16 gram gas A terbentuk dari reaksi antara 1 liter gas NO2 dan gas O2 berlebih menurut reaksi
4NO2(g) + 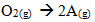
Jika reaksi tersebut berlangsung pada suhu 300C dengan tekanan 2 atm, maka massa molekul relatif gas A adalah …. (R=0,082 liter atm/mol K)
- 76
- 104
- 112
- 224
- 316
Jawaban: B
Pembahasan:
Massa gas A 2,24 gram
Suhu 300C + 273 =303 K
Tekanan 2 atm
Persamaan reaksi
4NO2(g) + 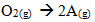
1 liter 0,5 liter
Persamaan gas ideal
P V = n R T
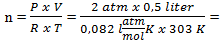 0,04 mol
0,04 mol
maka Mr = 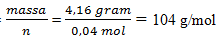 = 104 g/mol
= 104 g/mol

Topik: Larutan
Subtopik: Hasil Kali Kelarutan (Ksp)
6. Sebanyak 50 ml larutan Na2SO4 0,04 M ditambahkan ke dalam 50 ml larutan BaCl2 0,05 M. Jika Ksp BaSO4 1,0 x 10-10, maka pernyataan berikut yang benar adalah ….
- Larutan Na2SO4 sebagai pereaksi pembatas
- Konsetrasi Ba2+ sisa di dalam larutan sebanyak 0,01 M
- Kelarutan BaSO4 dalam air murni adalah 10-5 M
- Tidak terbentuk endapan BaSO4
Jawaban: B
Pembahasan:
Persamaan reaksi
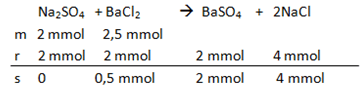
1) Na2SO4 sebagai reaksi pembatas (benar)
2) Sisa [Ba2+] =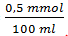 = 5 x 10-5 M (salah)
= 5 x 10-5 M (salah)
3) Ksp BaSO4 = 1,0 x 10-10, maka kelarutannya dalam air
BaSO4 ![]() Ba2+ + SO42-
Ba2+ + SO42-
Ksp = s s
Ksp = s2
S = 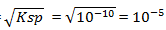 M (benar)
M (benar)
4)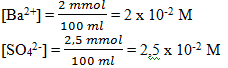
Maka Q = [Ba2+] [SO42-]
= 2 x 10-2 x 2,5 x 10-2 = 5 x 10-4
Nilai Q > Ksp, maka terbentuk endapan BaSO4 ( salah)

Topik: Kimia Organik
Subtopik: Oksidasi Alkohol
7. Senyawa organik dengan rumus molekul C5H12O jika dioksidasi akan menghasilkan senyawa dengan gugus keton. Senyawa tersebut adalah ….
- 3-metil-2-butanol
- 2-metil-2-butanol
- 3-metil-3-butanol
- 3-etil-1-propanol
- 3-pentanol
Jawaban: A
Pembahasan:
Senyawa yang memiliki rumus molekul C5H12O, yaitu alkohol dan eter. Antara keduanya yang dapat mengalami oksidasi adalah alkohol.
Alkohol primer bila dioksidasi akan menghasilkan senyawa aldehid dan jika dioksidasi lagi akan menghasilkan asam karboksilat sedangkan alkohol sekunder bila dioksidasi akan menghasilkan senyawa keton. Pada opsi di atas, senyawa alkohol yang dapat dengan mungkin berubah menjadi senyawa keton adalah pilihan A. Pilihan B mempunyai cabang pada atom karbon yang terikat dengan gugus OH sehingga sulit untuk menjadi senyawa keton, sedangkan pilihan C terdapat kesalahan pada tata nama.

Topik: Redoks
Subtopik: Reaksi Redoks
8. Persamaan reaksi berikut yang menunjukkan reaksi redoks adalah ….
- PbO2 + 4HCl à PbCl2 + 2H2O + Cl2
- 2Al + 3Cu(NO3)2 à 2Al(NO3)3 + 3Cu
- CS2 + 3O2 à CO2 + SO2
- ZnSO4 + KCl à ZnCl2 + K2SO4
Jawaban: A
Pembahasan:
Reaksi redoks adalah reaksi kimia yang ditandai dengan kenaikan biloks (oksidasi) sekaligus penurunan biloks (reduksi).
Persamaan reaksi 1,2 dan 3 merupakan redoks
Sedangkan persamaan reaksi 4 bukan redoks, karena tidak terjadi kenaikan maupun penurunan biloks.

Topik: Elektrokimia
Subtopik: Sel Elektrolisis
9. Suatu sel elektrokimia dengan elektrode Zn dan Ag pada keadaan standar menghasilkan arus 0,75 A selama 321 menit. Diketahui nilai
E0 Zn2+ I Zn = – 0,76 V
E0 Ag+ I Ag = + 0,8 V
Maka pengurangan massa di anoda adalah …. gram (F = 96.500 C)
- 3,250
- 4,875
- 6,321
- 10,850
- 13,106
Jawaban: B
Pembahasan :
Katoda : Ag+ + e ![]() Ag
Ag
Anoda : Zn ![]() Zn2+ + 2e-
Zn2+ + 2e-
Wanoda = 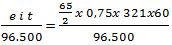 = 4,875 gram
= 4,875 gram

Topik: Kimia Organik
Subtopik: Isomer
10. Asam butanoat merupakan isomer gugus fungsi dari metil propanoat.
Sebab
Asam butanoat dan metil propanoat memiliki rumus molekul C4H8O2.
Jawaban: A
Pembahasan:
Asam butanoat merupakan turunan alkana yaitu asam karboksilat atau asam alkanoat dengan struktur
CH3 – CH2 – CH2 – COOH
Sedangkan metil propanoat merupakan turunan alkana yaitu ester atau alkil alkanoat dengan struktur
CH3 – CH2 – COO – CH3
Keduanya merupakan isomer gugus fungsi karena memiliki rumus molekul sama yaitu C4H8O2 tapi gugus fungsinya berbeda. Pada asam karboksilat gugus fungsinya –COOH sedangkan pada ester gugus fungsinya –COO –

Gimana, Squad? Sangat membantu ‘kan? Jangan lupa untuk terus buka ruangbaca karena masih akan banyak latihan dan pembahasan soal HOTS SBMPTN yang akan membantu persiapanmu. Psst, mau melakukan persiapan yang lebih ekstra? Lihat aja video pembahasan soal SBMPTN di ruangbelajar.














