Konsep Termokimia: Pengertian, Persamaan & Contoh Soal | Kimia Kelas 11

Yuk, kita belajar apa yang dimaksud dengan termokimia, persamaan termokimia, perubahan entalpi, hingga kalorimeter. Simak baik-baik di artikel Kimia kelas 11 ini, ya!
—
Apakah kamu pernah bertanya-tanya, kenapa tubuh kita bisa tetap hangat meski cuaca dingin? Atau kenapa es batu di minuman dingin yang kita beli perlahan meleleh? Nah, kedua fenomena tersebut adalah contoh dari ilmu termokimia.
Di artikel ini, kita akan bahas secara lengkap mengenai konsep termokimia. Mulai dari pengertian termokimia, persamaan termokimia, konsep dari perubahan entalpi, sampai mengenal alat-alat yang bisa mengukur kalor (panas) dalam reaksi termokimia, yaitu kalorimeter. Simak artikel ini, ya!
Apa itu Termokimia?
Dalam belajar kimia, pasti kita sering menganalisis suatu reaksi. Nah, rekasi kimia ini, erat kaitannya dengan perubahan energi. Oleh karena itu, memahami materi termokimia sangatlah penting.
Hmm, emangnya, termokimia itu apa sih? Termokimia adalah bagian dari ilmu kimia yang mempelajari perubahan energi dalam bentuk panas dari suatu reaksi kimia.
Lebih jelasnya seperti ini, setiap zat, baik itu gas, cairan, maupun padatan, memiliki energi yang tersimpan di dalamnya. Saat zat-zat tersebut bereaksi, energi tersebut bisa dilepaskan atau diserap, tergantung jenis reaksinya. Nah, perubahan energi ini biasanya berupa panas. Dan inilah yang dipelajari dalam materi termokimia kelas 11.
Baca Juga: Kesetimbangan Kimia: Jenis-Jenis, Persamaan Reaksi, dan Tetapan
Contoh Termokimia dalam Kehidupan
Fenomena termokimia itu banyak kita temui di sekitar kita, loh! Contohnya seperti yang sudah disampaikan di atas, yaitu tubuh yang tetap hangat meski kita berada dalam cuaca dingin, dan es yang meleleh. Kamu tau nggak alasannya kenapa?
Oke, kakak jelaskan contoh yang pertama dulu, ya. Saat cuaca dingin, terkadang tubuh kita tetap hangat. Hal ini bisa terjadi karena proses metabolisme yang menghasilkan panas sebagai produk sampingan. Ketika kita banyak melakukan aktivitas, metabolisme akan meningkat dan menghasilkan lebih banyak energi panas.
Kalo contoh kasus yang kedua, proses pencairan es terjadi karena es menyerap panas dari minuman di sekitarnya, atau dari luar gelas. Panas yang diserap oleh es digunakan untuk mengubah wujudnya dari padat menjadi cair. Inilah yang menyebabkan minuman kamu terasa lebih dingin.

Es mencair akibat panas dari medium di sekelilingnya. (Sumber: Giphy.com)
Gimana, paham nggak nih? Lalu, gimana sih konsep termokimia dalam suatu persamaan? Yuk, kita simak penjelasan berikut:
Persamaan Termokimia
Untuk melihat hubungan antara reaksi kimia dan panas yang terlibat dengan lebih nyata, kita bisa menggunakan persamaan termokimia. Persamaan ini menunjukkan bagaimana energi panas berhubungan dengan reaktan (zat-zat yang bereaksi) dan produk dalam suatu reaksi.
Contoh persamaan termokimia, kita bisa lihat pada reaksi pembakaran gas metana (CH₄) di udara, seperti di bawah ini:
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (l) (Δ𝐻= −890 kJ/mol)
Δ𝐻 disini adalah perubahan entalpi, yang menunjukkan apakah suatu reaksi menyerap atau melepaskan panas.
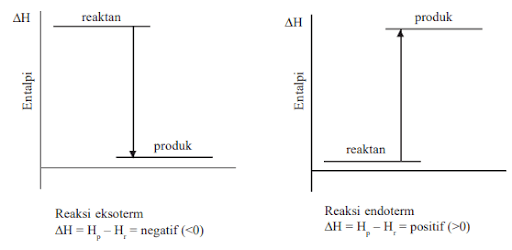
Besar Δ𝐻 yang bernilai negatif menunjukkan reaksi tersebut adalah eksoterm, yaitu reaksi yang melepaskan panas. Jadi, setiap satu mol gas metana yang dibakar akan melepaskan 890 kJ energi dalam bentuk panas.
Sebaliknya, jika Δ𝐻 dari suatu reaksi bernilai positif menunjukkan reaksi tersebut adalah reaksi endoterm atau reaksi yang menyerap panas.
Perubahan Entalpi (ΔH)
Nah, sejauh ini mungkin kamu bertanya-tanya ya, entalpi itu apa sih? Kok dari tadi istilah entalpi disebut-sebut melulu. Oke, sekarang kita kenalan lebih dalam dengan entalpi.
Entalpi adalah total energi dalam suatu sistem pada tekanan tetap, termasuk energi panas. Namun, kita tahu juga nih kalo pada “Hukum Kekekalan Energi”, menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, hanya dapat diubah dari bentuk energi satu menjadi bentuk energi yang lain.
Baca Juga: Memahami Hukum Kekekalan Energi
Jadi, yang dapat diukur hanyalah perubahan energi (ΔE). Demikian juga halnya dengan entalpi, entalpi tidak dapat diukur, kita hanya dapat mengukur perubahan entalpi (ΔH). Perubahan entalpi adalah total entalpi dari berlangsungnya suatu reaksi hingga menjadi produk.
Rumus perubahan entalpi adalah:
Δ𝐻 = 𝐻produk − 𝐻reaktan
Jika:
- ΔH bernilai negatif, artinya reaksi eksoterm dan panas dilepaskan dari sistem ke lingkungan.
- ΔH bernilai positif, artinya reaksi endoterm dan panas diserap dari lingkungan ke sistem.
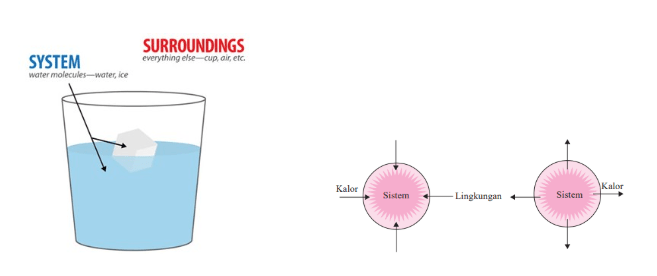
Lalu, sistem dan lingkungan termokimia maksudnya seperti apa sih? Sistem adalah reaktan dan produknya. Sedangkan lingkungan adalah segala sesuatu di luar reaktan dan produknya. Ilustrasinya seperti di bawah ini.
Kalorimeter
Lanjut, yaaaa. Mungkin di antara kamu ada yang penasaran lagi nih, ada gak sih alat pengukur kalor dari suatu reaksi? Tentu ada! Namanya kalorimeter.
Kalorimeter adalah alat yang digunakan untuk mengukur jumlah kalor (panas) yang dilepaskan atau diserap selama suatu reaksi kimia berlangsung.
Kalorimeter, seperti gambar yang dapat kamu lihat di bawah ini, terdiri dari wadah isolasi yang dirancang agar panas dari reaksi tidak keluar, sehingga pengukuran kalor bisa dilakukan secara akurat.

Gambar Kalorimeter.
Kalorimeter terbagi menjadi dua jenis, yaitu kalorimeter bom dan kalorimeter sederhana. Kalorimeter bom adalah wadah logam tertutup tempat berlangsungnya reaksi, yang biasanya digunakan untuk mengukur jumlah kalor yang dilepaskan saat pembakaran sempurna.
Sedangkan, kalorimeter sederhana atau biasa merupakan wadah yang diisolasi secara termal yang dapat dibuat dari wadah atau gelas yang sifatnya isolator (tidak menghantarkan panas).
Baca Juga: Laju Reaksi dan Faktor-Faktor yang Memengaruhinya
Untuk mengetahui besar kalori dari suatu reaksi, kamu bisa menggunakan rumus kalorimeter di bawah ini.
Jika menggunakan rumus kalorimeter bom, caranya sebagai berikut:
Qreaksi = – (Qkalorimeter + Qair)
Qkalorimeter = Ckalorimeter × ∆T
Lalu, untuk rumus kalorimeter sederhana adalah sebagai berikut.
Qreaksi = – (Qkalorimeter + Qlarutan)
atau
Qreaksi = – Qlarutan
Qreaksi = m × c × ∆T
Keterangan:
Qreaksi = kalor reaksi (J atau KJ)
m = massa (g atau kg)
c = kalor jenis (J/g°C atau K/kg K)
Ckalorimeter = kapasitas kalor pada kalorimeter (J°C-1 atau JK-1)
∆T = perubahan suhu (°C atau K)
Contoh Soal Cara Menghitung Perubahan Entalpi
Agar lebih paham tentang materi termokimia, mari kita coba kerjakan contoh soal termokimia berikut.
Berapa perubahan entalpi dari reaksi pembakaran 2 mol metana (CH₄)? Jika ΔH untuk reaksi pembakaran 1 mol metana adalah -890 kJ/mol.
Penyelesaiannya sebagai berikut:
Diketahui ΔH pembakaran 1 mol metana adalah -890 kJ/mol. Maka, untuk 2 mol metana:
ΔHtotal = 2 × (−890 kJ/mol) = −1.780kJ
Artinya, untuk membakar 2 mol metana, akan dilepaskan 1.780 kJ energi panas. Ini adalah contoh reaksi eksoterm, di mana panas dilepaskan selama proses pembakaran.
—
Bagaimana, apakah kamu sudah cukup paham dengan materi termokimia di atas?
Termokimia bukan hanya sekadar teori yang ada di buku teks, melainkan ilmu yang sangat relevan dengan kehidupan sehari-hari. Konsep-konsep termokimia bisa membantu kamu memahami bagaimana panas dan energi bekerja dalam reaksi kimia.
Yuk, terus belajar dan eksplorasi ilmu sains di sekitar kita! Kalau kamu merasa tertarik untuk mempelajari materi ini lebih dalam lagi, kamu bisa coba belajar bareng kakak-kakak Tutor berpengalaman di Ruangguru Privat!
Belajar nggak cuma menyenangkan, tapi kamu juga bakal diajari konsepnya sampai paham! Para pengajar di Ruangguru Privat juga sudah terstandarisasi kualitasnya, loh. Kamu juga bisa pilih nih, mau diajarkan secara langsung (offline) atau daring (online). Fleksibel, kan? Untuk info lebih lanjut, cuss klik link berikut!
Referensi:
Munasprianto, R. Kimia Kelas XI SMA. 2022. [Daring]. Tautan: https://static.buku.kemdikbud.go.id/content/pdf/bukuteks/kurikulum21/Kimia-BS-KLS-XI.pdf (Diakses pada 30 September 2024)
Sumber Gambar:
GIF ‘Es Mencair’. [Daring]. Tautan: https://giphy.com/gifs/black-and-white-ice-rad-IIV8h7iMDr3P2 (Diakses pada 1 Februari 2025)
![[AB] Web Side Banner - Blog RG](https://cdn-web-2.ruangguru.com/landing-pages/assets/a1fcbd04-bf7f-41b1-9ae5-6f1ea4b1c4b6.png)















