Kesetimbangan Kimia: Jenis-Jenis, Persamaan Reaksi, dan Tetapan | Kimia Kelas 11

Apa yang dimaksud dengan kesetimbangan kimia? Yuk, pelajari tentang kesetimbangan kimia, mulai dari jenis-jenis, persamaan reaksi, hingga tetapannya di artikel Kimia kelas 11 berikut!
—
Kamu pernah ikut Ibumu ke pasar membeli beras? Misalnya, kamu dan ibumu membeli beras sebanyak 1 kg, lalu pedagang akan mengukur dengan anak timbangan yang memiliki massa sebesar 1 kg pula, kan? Tentu saja pedagang tersebut juga akan memastikan agar berat beras dapat seimbang dengan anak timbangan.
Nah, kasus ini merupakan salah satu contoh dari kesetimbangan kimia. Semua benda yang diam dan tidak bergerak dapat dikatakan selalu ada di dalam keadaan setimbang.
Pengertian Kesetimbangan Kimia
Kesetimbangan kimia adalah keadaan saat kedua reaktan dan produk hadir dalam konsentrasi yang tidak memiliki kecenderungan lebih lanjut untuk berubah seiring berjalannya waktu.
Baca Juga: Benarkah Larutan Penyangga Bisa Menstabilkan pH?
Ciri-Ciri Kesetimbangan Kimia
Ciri-ciri kesetimbangan kimia dapat kamu lihat pada infografik berikut:

Jenis-Jenis Kesetimbangan Kimia
Kesetimbangan kimia terdiri atas dua macam, yaitu kesetimbangan statis dan kesetimbangan dinamis. Kesetimbangan statis terjadi jika reaksi kimia yang dihasilkan merupakan reaksi kimia satu arah atau reaksi kimia yang tidak dapat kembali lagi seperti semula.
Sedangkan kesetimbangan dinamis terjadi jika reaksi kimia yang dihasilkan merupakan reaksi kimia dua arah atau reaksi kimia yang bisa kembali lagi seperti semula.
Ketika kamu membakar selembar kertas, abu yang dihasilkan tidak dapat berubah menjadi kertas lagi. Hal ini termasuk contoh kesetimbangan statis.
Akan tetapi, walau sama-sama menghasilkan reaksi, air yang direbus hingga menghasilkan uap akan memberi reaksi yang berbeda dengan kertas yang dibakar menjadi abu. Mengapa?
Sebab, jika uap terkena tutup panci atau benda lainnya maka akan berubah kembali menjadi air. Nah, hal ini disebut dengan kesetimbangan dinamis karena ada perubahan dua arah.

Air yang direbus dalam panci tertutup (Sumber: wikipedia.org)
Kesetimbangan dinamis bekerja saat kecepatan reaksi pembentukan produk sama dengan kecepatan pembentukan reaktan. Ingat, dalam kesetimbangan dinamis akan selalu ada perubahan menuju produk dan perubahan kembali menjadi reaktan. Kesetimbangan dinamis dilambangkan dengan tanda panah dua arah (⇌).
Baca Juga: Penjelasan Titrasi Asam Basa, Kurva, Langkah & Contoh Perhitungannya
Persamaan Reaksi Kesetimbangan Kimia
Jika suhu tetap gas A berada dalam kondisi setimbang dengan gas B, maka persamaan reaksinya dapat ditulis sebagai berikut:
aA(g) ⇌ bB(g)
Apabila gas A dalam keadaan setimbang dengan gas B, maka kecepatan pembentukan gas B pasti sama dengan kecepatan pembentukan kembali gas A.
Sudah paham kan? Nah, tiap gas A berubah sebanyak a mol, maka B juga akan berubah sebanyak b mol. Perbandingan mol A dan mol B akan selalu tetap.
Tetapan Kesetimbangan Kimia
Tetapan kesetimbangan kimia adalah angka yang menunjukkan perbandingan secara kuantitatif antara produk dengan reaktan. Secara umum reaksi kesetimbangan dapat dituliskan sebagai berikut.
aA + bB ⇌ cC + dD
Saat di dalam reaksi kesetimbangan dilakukan aksi, maka kesetimbangan akan bergeser dan sekaligus mengubah komposisi zat-zat yang ada untuk kembali mencapai kesetimbangan.
Secara umum, dapat dikatakan tetapan kesetimbangan merupakan perbandingan hasil kali molaritas produk dengan hasil kali molaritas reaktan yang masing-masing dipangkatkan dengan koefisiennya.
Baca Juga: Mengenal Energi dan Perubahannya dalam Sistem

Tetapan kesetimbangan (K), sering juga dituliskan KC. Pada artikel ini digunakan simbol KC untuk harga tetapan kesetimbangan.
Contoh Soal Kesetimbangan Kimia
Satu liter campuran gas pada suhu 100°C pada keadaan setimbang mengandung 0,0045 mol dinitrogen tetraoksida dan 0,03 mol nitrogen dioksida.
- Tuliskan rumus tetapan kesetimbangan gas tersebut.
- Hitung tetapan kesetimbangannya.
Jawab:
N2O4(g) ⇌ NO2(g)
Persamaan di atas harus disetarakan dulu menjadi
N2O4(g) ⇌ 2NO2(g)
a. Tetapan kesetimbangan dituliskan sebagai perbandingan molaritas produk (nitrogen dioksida) dengan molaritas reaktan (dinitrogen tetraoksida) yang masing-masing dipangkatkan dengan koefisiennya, sehingga dapat dituliskan sebagai berikut.
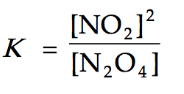
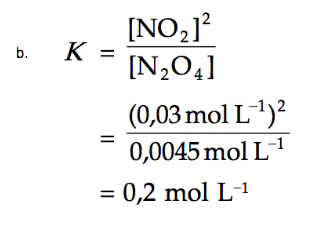
Jadi, tetapan kesetimbangannya sebesar 0,2.
Sekarang, coba kamu kerjakan soal latihan berikut ya. Beri jawabannya di kolom komentar.
- Apa yang dimaksud dengan tetapan kesetimbangan? Jelaskan!
- Tuliskan rumusan tetapan kesetimbangan pembentukan amoniak dari gas hidrogen dan gas nitrogen berikut.
3H2(g) + N2(g) ⇌ 2NH3(g)
- Hitung tetapan kesetimbangan pada soal nomor 2, jika dalam keadaan setimbang (suhu 300°C) 1 Liter campuran gas mengandung 0,15 mol gas hidrogen; 0,25 mol gas nitrogen; dan 0,1 mol gas amoniak.
Kalau bingung mengerjakannya, cobain deh belajar pakai Ruangguru Privat dan temukan pembahasan yang mudah dimengerti dari guru hanya dari hp-mu. Pasti kamu akan lebih memahami dan belajar jadi lebih praktis!
Belajar nggak cuma menyenangkan, tapi kamu juga bakal diajari konsepnya sampai paham! Para pengajar di Ruangguru Privat juga sudah terstandarisasi kualitasnya, loh. Kamu juga bisa pilih nih, mau diajarkan secara langsung (offline) atau daring (online). Fleksibel, kan? Untuk info lebih lanjut, cuss klik link berikut!
Sumber Gambar:
Gambar ‘Air Mendidih dalam Panci’. [Daring]. Tautan: https://ja.wikipedia.org/wiki/%E3%83%95%E3%82%A1%E3%82%A4%E3%83%AB:2008-07-05_Water_boiling_in_cooking_pot.jpg (Diakses: 23 November 2021)
















