Latihan Soal Ujian Nasional 2019 Kimia SMA dan Pembahasannya

Artikel kali ini akan menyajikan beberapa latihan soal untuk ujian nasional tahun 2019 jenjang SMA dengan mata pelajaran Kimia. Disertai juga pembahasannya lho. Semoga bermanfaat ya dan sukses untuk ujian nasional nanti.
—
Bagi kamu anak IPA, pastinya pelajaran Kimia menjadi salah satu pelajaran yang difavoritkan dong ya? Eits, jangan ada alasan kalau pelajaran Kimia itu sulit lho Squad. Ketika kamu memilih jurusan IPA harusnya sudah tahu konsekuensinya dong. MAFIA (matematika, fisika, kimia) menjadi mata pelajaran yang mutlak harus kamu kuasai.
Berhubung minggu depan sudah masuk dalam masa-masa ujian nasional, blog Ruangguru menghadirkan latihan soal yang bisa kamu gunakan untuk memperdalam pemahaman kamu khususnya dalam mata pelajaran Kimia. Sudah cukup ya basa basinya, yuk kita mulai belajarnya.

1. Topik : Hubungan konfigurasi elektron
Perhatikan konfigurasi elektron di bawah ini!
Y : [Ne]3s23p5
Dari konfigurasi elektron di atas, dapat disimpulkan bahwa unsur Y berada pada….
A. periode 3, golongan VIIA
B. periode 3, golongan VIIB
C. periode 3, golongan VA
D. periode 5, golongan IIIA
E. periode 5, golongan IIIB
Jawaban : A
Pembahasan :
Golongan dapat ditentukan dengan melihat elektron valensi suatu unsur.
Elektron valensi unsur Y adalah 3s2 3p5. Elektron valensi unsur Y berjumlah 7 elektron. Karena orbital terakhir adalah orbital s dan p, maka dapat disimpulkan bahwa unsur Y terletak pada golongan VIIA.
Periode dapat ditentukan dengan melihat kulit (n) terbesar dalam konfigurasi elektronnya. Unsur Y memiliki kulit terbesar n = 3, sehingga terletak pada periode 3.

2. Topik : Teori Hibridisasi
Perhatikan konfigurasi elektron berikut!
P : 1s2 2s2 2p2
Q : 1s2 2s2 2p6 3s2 3p5
Jika P dan Q membentuk senyawa PQ4, bentuk molekulnya adalah….
A. tetrahedron
B. segitiga piramida
C. bengkok
D. bentuk T
E. segiempat datar
Jawaban : A
Pembahasan:
P : 1s2 2s2 2p2
Q : 1s2 2s2 2p6 3s2 3p5
Senyawa PQ4 memiliki atom P sebagai atom pusatnya, sehingga atom P harus menyediakan elektron tak berpasangan untuk berikatan dengan atom Q.
Hibridisasi senyawa PQ4 yaitu :
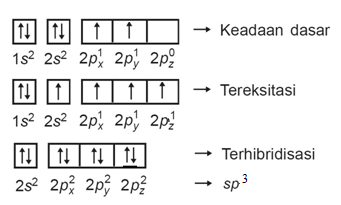
Senyawa PQ4 memiliki hibridisasi sp3, maka bentuk molekulnya adalah tetrahedral.

3. Topik : Trayek pH
Perhatikan data uji pH dua buah air limbah berikut!
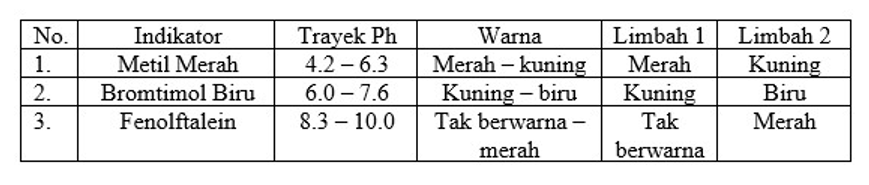
Dari hasil pengujian maka pH air limbah 1 dan limbah 2 berturut – turut adalah….
A. pH ≤ 8,3 dan pH ≥ 10
B. pH ≤ 4,2 dan pH ≥ 10
C. 4,2 ≤ pH ≤ 8,3 dan pH ≥ 10
D. 4,2 ≤ pH ≤ 6,0 dan 7,6 ≤ pH ≤ 10
E. 4,2 ≤ pH ≤ 8,3 dan pH ≤ 10
Jawaban : D
Pembahasan :
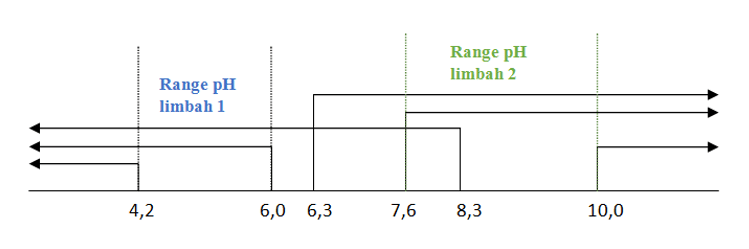
Limbah 1 :
- Hasil uji metil merah menunjukkan warna merah, artinya memiliki pH ≤ 4,2.
- Hasil uji bromtimol biru menunjukkan warna kuning, artinya memiliki pH ≤ 6,0.
- Hasil uji fenolftalein menunjukkan tak berwarna, artinya memiliki pH ≤ 8,3.
Limbah 2 :
- Hasil uji metil merah menunjukkan warna kuning, artinya memiliki pH ≥ 6,3.
- Hasil uji bromtimol biru menunjukkan warna biru, artinya memiliki pH ≥ 7,6.
- Hasil uji fenolftalein menunjukkan merah, artinya memiliki pH ≥ 10.
Range pH untuk limbah 1 adalah 4,2 ≤ pH ≤ 6,0.
Range pH untuk limbah 2 adalah 7,6 ≤ pH ≤ 10,0.

4. Topik : Titrasi berdasarkan grafik
Perhatikan grafik berikut!
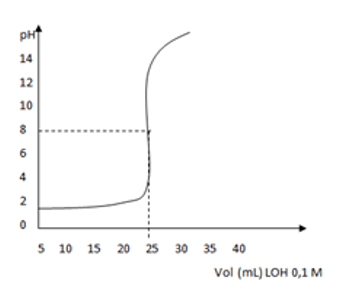
Untuk melakukan titrasi seperti gambar di atas, digunakan indikator….
A. metil orange
B. metil jingga
C. phenolphtalein
D. bromtimol biru
E. metil merah
Jawaban : C
Pembahasan :
Grafik di atas menunjukkan titrasi antara asam kuat dan basa kuat. Hal ini ditunjukkan dari grafik yang dimulai pada angka sekitar 2 sehingga menujukkan asam kuat dan diakhiri pada grafik sekitar pH 14, dimana untuk titrasi asam kuat dengan basa kuat indikator yang cocok digunakan adalah indikator phenolphtalein.

5. Topik : Endapan Ksp
Sebanyak 100ml CaCl2 0.6M dicampur dengan 100ml Na2CO3 0.6M. jika Ksp CaCO3 = 2.8 x 10 -9, massa zat yang mengendap adalah…. (Ar. Ca = 40, C = 12, O = 16, Na = 23, Cl = 35.5)
A. 6 gram
B. 9 gram
C. 60 gram
D. 100 gram
E. 120 gram
Jawaban : A
Pembahasan :
Mol CaCl2 = M x V = 0.6M x 100ml = 60mmol
Mol Na2CO3 = M x V = 0.6M x 100ml = 60mmol
CaCl2 + Na2CO3 → CaCO3 + 2NaCl

Qsp = [Ca2+][CO32-] = 0.3 x 0.3 = 0.09
Qsp > Ksp maka membentuk endapan
Massa zat yang mengendap = mol x Mr = 0.06 mol x 100 = 6 gram

6. Topik : Larutan elektrolit dan non elektrolit
Perhatikan gambar di bawah ini!
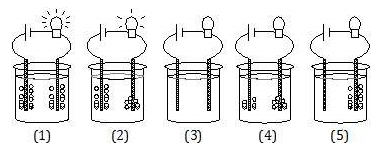
Dari gambar di atas yang tergolong larutan elektrolit kuat adalah….
A. (1) dan (2)
B. (1) dan (4)
C. (2) dan (3)
D. (3) dan (4)
E. (4) dan (5)
Jawaban : A
Pembahasan :
Elektrolit kuat dapat dilihat dari lampu yang menyala terang dan menghasilkan gelembung yang banyak, maka jawabannya adalah nomor (1) dan (2). Gambar nomor (3) adalah larutan non elektrolit karena lampu padam dan tidak ada gelembung. Gambar nomor (4) dan (5) merupakan larutan elektrolit lemah, karena lampu padam tetapi terdapat gelembung.

7. Topik : Faktor Korosi
Perhatikan percobaan di bawah ini!
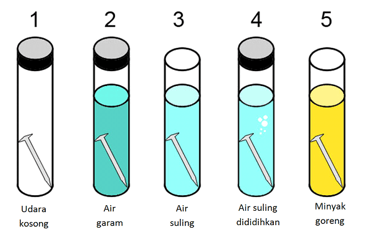
Dari percobaan di atas yang memperlambat proses korosi pada paku adalah….
- 1 2 c. 3 d. 4 e. 5
Jawaban : E
Pembahasan :
Korosi adalah proses teroksidasinya suatu logam oleh berbagai zat menjadi senyawa.
Korosi dapat disebabkan karena adanya air dan oksigen.
Pencegahan korosi dapat dilakukan dengan beberapa cara yaitu :
- melapisi logam dengan cat, minyak atau oli, dan logam lain yang tahan korosi misalnya nikel dan perak.
- perlindungan katoda, misalnya logam yang dilindungi dari korosi diposisikan sebagai katoda.
- membuat alloy atau paduan logam, misalnya besi dicampur dengan logam Ni dan Cr menjadi baja stainless.
Paku yang tercelup pada minyak akan memperlambat proses korosi, karena ketika paku dicelupkan ke dalam minyak, tidak ada udara yang akan kontak langsung dengan minyak, sehingga akan memperlambat proses korosi pada paku.
Baca Juga: Latihan Soal Ujian Nasional 2019 Matematika IPA dan Pembahasannya

8. Topik : Energi ikatan
Diketahui energi disosiasi ikatan:
C – H : 415kJ/mol
C – C : 345kJ/mol
C = C : 611kJ/mol
H – Br : 370kJ/mol
C – Br : 275kJ/mol
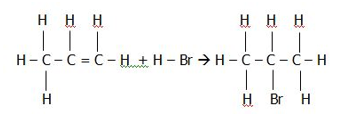
Hitunglah energi ikatan untuk reaksi di atas….
A. −54kJ/mol
B. +54kJ/mol
C. −108kJ/mol
D. +108kJ/mol
E. +162kJ/mol
Jawaban : A
Pembahasan :
∆H = ∑energi ikatan kiri – ∑energi ikatan kanan
=[ 6(C–H) + (C–C) + (C=C) + (H–Br)] –[7(C–H) + (C–Br) + 2(C–C)]
= [6(415) + 345 + 611 + 370] – [7(415) + 275 + 2(345)]
= 3816 – 3870
= −54kJ/mol

9. Topik : Hukum Faraday
Elektrolisis larutan CuSO4 selama 30 menit dengan arus 10A, akan menghasilkan endapan logam Cu di katoda sebanyak…. (Ar Cu = 63,5)
A. 0,181 gram
B. 0,373 gram
C. 1,845 gram
D. 5,922 gram
E. 23,689 gram
Jawaban : C
Pembahasan:
Diketahui : i = 10 A
t = 30 menit = 30 x 60 sekon
Ar Cu = 63,5
CuSO4 Cu2+ + SO42- (biloks Cu = +2)
Ditanya : massa Cu
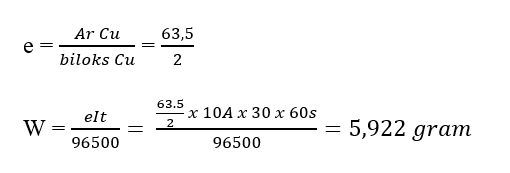

10. Topik : Fenomena sifat koligatif
Pernyataan yang benar mengenai sifat koligatif larutan elektrolit dan nonelektrolit dengan molalitas yang sama adalah….
A. titik didih larutan elektrolit lebih rendah dibanding larutan nonelektrolit
B. titik beku larutan elektrolit lebih rendah dibanding larutan nonelektrolit
C. titik didih larutan elektrolit sama dengan titik didih larutan nonelektrolit
D. tekanan uap larutan elektrolit lebih tinggi dibandingkan larutan nonelektrolit
E. tekanan osmosis larutan elektrolit lebih rendah dari larutan nonelektrolit
Jawaban : B
Pembahasan:
Di dalam air, zat elektrolit akan terurai menjadi ion-ionnya sehingga jumlah zat terlarutnya akan lebih banyak dibanding nonelektrolit dengan molalitas yang sama. Hal itu menyebabkan :
- Titik didih larutan elektrolit lebih tinggi dibandingkan larutan nonelektrolit.
Adanya zat terlarut akan menghalangi pelarut (air) untuk mendidih pada titik didihnya, sehingga pada larutan elektrolit diperlukan titik didih yang lebih tinggi dari titik didih air.
- Titik beku larutan elektrolit lebih rendah dibandingkan larutan nonelektrolit.
Adanya zat terlarut akan menghalangi air untuk membeku pada titik bekunya, sehingga pada larutan elektrolit diperlukan titik beku yang lebih rendah dari titik beku air.
- Tekanan uap larutan elektrolit lebih rendah daripada larutan nonelektrolit
Semakin banyak zat terlarut, maka semakin banyak partikel yang menghalangi pelarut (air) untuk menguap. Akibatnya, jumlah molekul yang menguap menjadi lebih sedikit, dan tekanan uap menjadi lebih kecil.
- Tekanan osmotik larutan elektrolit lebih tinggi daripada larutan nonelektrolit
Semakin banyak zat terlarut, maka semakin banyak molekul-molekul air yang bergerak melewati membran semipermeabel. Akibatnya, tekanan osmotik menjadi lebih besar.

11. Topik : Kespontanan reaksi
Diketahui data potensial reduksi sebagai berikut:
E0 Ca2+/Ca = – 2.87V
E0 Pb2+/Pb = -0.13V
E0 Mg2+/Mg = -2.37V
E0 Au3+/Au = +1.5 V
Reaksi yang dapat berlangsung adalah….
A. Mg + Ca2+ → Mg2+ + Ca
B. Ca + Mg → Ca2+ + Mg2+
C. Pb + Mg2+ → Pb2+ + Mg
D. Mg + Pb2+ → Mg2+ + Pb
E. Pb2+ + Au3+ → Pb + Au
Jawaban : D
Pembahasan :
Reaksi yang dapat berlangsung (spontan) ditandai dengan potensial reaksi (E0sel) yang bernilai positif (> 0)
Untuk reaksi pada jawaban (b) dan (e) bukan merupakan reaksi redoks, sehingga tidak perlu dihitung.
E0sel = E0red – E0oks
Pada pilihan A : E0sel = (E0 Ca2+/Ca) – (E0 Mg2+/Mg)
E0sel = – 2.87V – (-2.37V) = – 0.5V
Pada pilihan C : E0sel = (E0 Mg2+/Mg) – (E0 Pb2+/Pb)
E0sel = – 2.37V – (-0.13V) = – 2.24V
Pada pilihan D : E0sel = (E0 Pb2+/Pb) – (E0 Mg2+/Mg)
E0sel = -0.13V – (-2.37V) = +2.24V
Maka, reaksi yang dapat berlangsung adalah Mg + Pb2+ → Mg2+ + Pb
Karena nilai E0sel > 0

12. Topik : Reaksi hidrokarbon
Perhatikan reaksi hidrokarbon berikut ini!
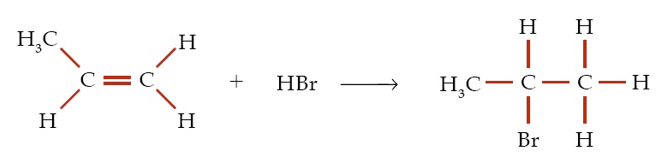
Reaksi di atas termasuk jenis reaksi….
A. eliminasi
B. substitusi
C. adisi
D. asimilasi
E. pembakaran
Jawaban : C
Pembahasan :
Reaksi antara alkena dengan asam bromida dan menghasilkan haloalkana merupakan reaksi adisi.
Ciri – ciri pada reaksi adisi adalah senyawa hidrokarbon yang memiliki ikatan rangkap (tidak jenuh) berubah menjadi hidrokarbon berikatan tunggal (jenuh), dengan adanya penambahan atom lain.

13. Topik : Turunan benzena
Perhatikan struktur turunan senyawa benzena berikut ini!
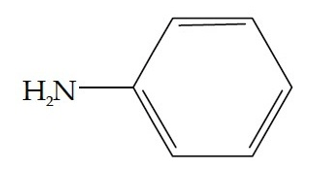
Senyawa turunan benzena di atas dinamakan….
A. fenol
B. toluena
C. anilina
D. anisol
E. stirena
Jawaban : C
Pembahasan :
Senyawa turunan benzena yang berikatan dengan satu substituen, secara IUPAC diberi nama dengan aturan : nama substituen + benzena
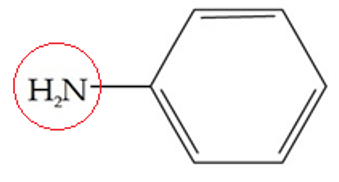
NH2 merupakan gugus amin, maka nama IUPAC senyawa ini adalah : aminobenzena
Nama trivialnya : anilina
Jika benzena berikatan dengan – OH dinamakan hidroksibenzena (fenol).
Jika benzena berikatan dengan – CH3 dinamakan metilbenzena (toluena).
Jika benzena berikatan dengan – OCH3 dinamakan metoksibenzena (anisol).
Jika benzena berikatan dengan CH = CH2 dinamakan vinilbenzena (stirena).

14. Topik : Uji karbohidrat, protein dan lemak
Suatu zat X jika direaksikan dengan pereaksi Fehling terbentuk endapan merah bata. Maka zat X tersebut kemungkinan mengandung….
A. selulosa
B. sukrosa
C. amilum
D. glikogen
E. fruktosa
Jawaban : E
Pembahasan:
Pereaksi Fehling digunakan untuk mengidentifikasi gula pereduksi, yaitu gula yang mengandung gugus aldehid dan keton bebas. Reaksi positif Fehling akan menghasilkan endapan merah bata. Semua monosakarida dan disakarida (kecuali sukrosa) merupakan gula pereduksi, sedangkan semua polisakarida bukan gula pereduksi.
Maka, karbohidrat yang akan bereaksi positif terhadap Fehling kemungkinan mengandung fruktosa. Dalam reaksi ini, fruktosa akan mereduksi ion Cu2+ dalam Fehling menjadi ion Cu+ sehingga dihasilkan endapan merah bata.
Baca Juga: Latihan Soal Ujian Nasional 2019 Fisika SMA dan Pembahasannya

15. Topik : Reduktor Oksidator
Perhatikan reaksi redoks berikut!
2Cr + 3CuSO4 → Cr2(SO4)3 + 3Cu
Pada reaksi tersebut yang merupakan reduktor adalah….
A. Cr
B. CuSO4
C. Cu
D. Cr2(SO4)3
E. Cr dan CuSO4
Jawaban : A
Pembahasan :
Reduktor adalah suatu spesi yang mereduksi zat lainnya, namun spesi itu sendiri mengalami oksidasi.
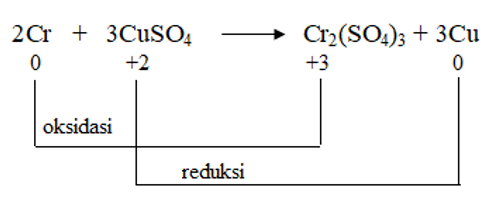
Pada reaksi di atas, Cr mengalami perubahan biloks dari 0 menjadi +3, maka Cr mengalami oksidasi. Jadi, Cr bertindak sebagai reduktor.

16. Topik : Kimia Dasar
Indikator : Peserta didik dapat mengidentifikasi jenis ikatan dari reaksi senyawa
Suatu unsur diketahui memiliki konfigurasi elektron sebagai berikut
Y : [He] 2s2
X : [Ne] 3s23p5
Ikatan yang terjadi antara kedua unsur tersebut adalah ikatan….
A. hidrogen
B. ion
C. kovalen
D. koordinasi
E. ganda
Jawaban : C
Pembahasan :
Umumnya atom dengan elektron valensi 1, 2, dan 3 akan melepaskan elektron terluarnya (membentuk ion positif) untuk mencapai kestabilan oktet. Sehingga ikatan yang terbentuk berupa ikatan ionik. Namun, karena unsur Y ini memiliki jari – jari yang kecil (terlihat dari nomor atom kecil dan konfigurasi elektron yang singkat), maka jenis ikatan yang terbentuk cenderung dengan sharing elektron terluarnya untuk mencapai kestabilan oktet. Struktur lewis dari kedua unsur dalam membentuk suatu senyawa adalah sebagai berikut :
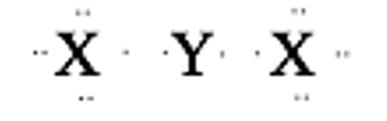
Senyawa YX2 tersebut terbentuk dari sharing (saling memberi) antara kedua elektron valensi Y dengan elektron dari unsur X. Walaupun tidak memenuhi aturan oktet, senyawa tersebut termasuk ikatan kovalen.

17. Topik : Kimia Analitik
Indikator : Peserta didik mengidentifikasi daerah penyangga dan daerah hidrolisis
Perhatikan kurva titrasi dibawah ini! Kurva tersebut adalah titrasi antara larutan CH3COOH dan larutan KOH.
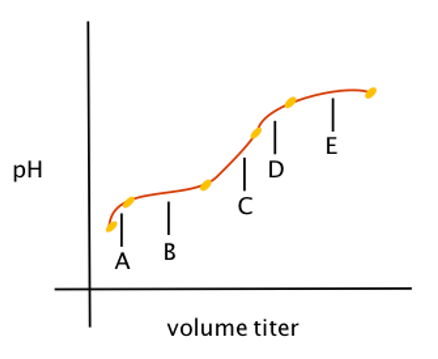
Komposisi larutan yang apabila dicampurkan menunjukkan perubahan pH pada daerah B adalah….
A. CH3COOH 0,2 mol dan Mg(OH)2 0,1 mol
B. CH3COOH 0,3 mol dan KOH 0,2 mol
C. NH4OH 0,1 mol dan HCl 0,05 mol
D. HCOOH 0,2 mol dan Mg(OH)2 0,04 mol
E. HCl 1 mol dan NaOH 1 mol
Jawaban : B
Pembahasan :
Kurva titrasi di atas termasuk titrasi larutan CH3COOH (asam lemah) dengan larutan KOH (basa kuat). Pada daerah B merupakan daerah pH sistem penyangga, dimana pHnya cenderung tetap (tidak berubah secara signifikan) ketika penambahan sedikit basa sebagai pentiter. Larutan penyangga adalah campuran antara asam/basa lemah dengan basa/asam kuat dimana jumlah mol asam/basa lemah lebih besar daripada mol basa / asam kuat. Dalam percobaan ini, maka jumlah mol asam lemah CH3COOH harus lebih besar dari jumlah mol basa kuat KOH.

18. Topik : Kimia Fisik
Indikator : Peserta didik dapat memprediksi arah pergeseran kesetimbangan
Berikut ini adalah reaksi kesetimbangan.
4 A(s) + 2 B(g) ⇋ 2 C(g) ∆H = – 60 kJ
Keadaan yang akan menyebabkan kesetimbangan bergeser ke arah kiri (membentuk reaktan lebih banyak) adalah….
A. menurunkan suhu
B. menaikkan suhu
C. menambah konsentrasi A
D. menambahkan volume
E. menaikkan tekanan
Jawaban : B
Pembahasan :
Faktor – faktor yang memengaruhi kesetimbangan antara lain :
- konsentrasi : jika konsentrasi spesi di salah satu ruas dinaikkan, maka kesetimbangan akan bergeser ke ruas sebaliknya. Jika konsentrasi spesi di salah satu ruang diturunkan, maka kesetimbangan akan bergeser ke arah ruas tersebut
- volume : jika volume sistem dinaikkan, maka kesetimbangan bergeser ke ruas dengan koefisien yang besar (hanya koefisien gas dan aqueous yang dihitung) dan sebaliknya.
- Tekanan : jika tekanan sistem dinaikkan, maka kesetimbangan akan bergeser ke ruas dengan koefisien yang kecil (hanya koefisien gas dan aqueous yang dihitung) dan sebaliknya).
- Suhu : jika suhu dinaikkan, maka reaksi akan bergeser ke arah endoterm dan sebaliknya. (nilai ∆H yang diketahui adalah untuk reaksi ke kanan)
- Katalis : zat yang hanya mempercepat tercapainya kesetimbangan tanpa menggeser arah kesetimbangan
Maka pada reaksi 4 A(s) + 2 B(g) ⇋ 2 C(g) ∆H = – 60 kJ, menggeser kesetimbangan ke arah kiri (ke ruas reaktan) dapat dilakukan dengan :
- meningkatkan konsentrasi produk (ruas kanan)
- meningkatkan suhu reaksi. Karena reaksi memiliki ∆H = -, maka peningkatan suhu akan menggeser kesetimbangan ke arah kiri (endoterm)
- volume dan tekanan tidak memengaruhi reaksi tersebut, karena koefisien kiri = koefisien kanan.

19. Topik : Kimia Organik
Indikator : Peserta didik dapat menentukan nilai koefisien berdasarkan penyetaraan reaksi redoks menggunakan metode setengah reaksi asam setengah reaksi basa
Perhatikan reaksi redoks di bawah ini!
a MnO4 + b I– → c MnO2 + d I2
Nilai a, b, c, dan d berturut-turut dengan penyetaraan metode setengah reaksi basa adalah….
A. 1, 2, 2, dan 3
B. 2, 2, 4, dan 3
C. 2, 4, 2, dan 3
D. 2, 6, 2, dan 3
E. 1, 2, 8, dan 3
Jawaban : D
Pembahasan :
Aturan penyetaraan reaksi redoks adalah sebagai berikut :
- menuliskan masing-masing reaksi yang mengalami reduksi dan oksidasi
Reduksi : MnO4– → MnO2
Oksidasi : I– → I2
- menyetarakan atom selain atom O dan H
Reduksi : MnO4– → MnO2
Oksidasi : 2I– → I2
- pada suasana basa, atom O disetarakan dengan menambah ion OH– di ruas yang kekurangan O karena pada kondisi basa dan atom Hdisetarakan diruas sebaliknya dengan menambah H2O
Reduksi : MnO4– + 2H2O → MnO2 + 4OH–
Oksidasi : 2I– → I2
- menyetarakan muatan dengan menambah elektron
Reduksi : MnO4– + 2H2O + 3e– → MnO2 + 4OH– x 2
Oksidasi : 2I– → I2 + 2e– x 3
Hasil nya adalah
2MnO4– + 4H2O + 6I– → 2MnO2 + 8OH– + 3I2
Sehingga nilai a, b, c, dan d adalah 2, 6, 2, 3

20. Topik : Kimia Anorganik
Indikator : Peserta didik dapat mengidentifikasi sifat asam-basa berdasarkan Arhenius, Lewis, dan Bronsted-Lowry
Dalam reaksi BF3 + NH3 → NH3BF3, BF3 bertindak sebagai….
A. basa Bronsted-Lowry
B. basa Lewis
C. asam Lewis
D. asam Bronsted-Lowry
E. asam Arrhenius
Jawaban : C
Pembahasan :
Menurut teori asam – basa Lewis :
- asam : spesi yang bertindak sebagai penerima pasangan elektron bebas (akseptor PEB)
- basa : spesi yang bertindak sebagai pendonor pasangan elektron bebas (donor PEB)
Reaksi antara NH3 dengan BF3 digambarkan sebagai berikut :
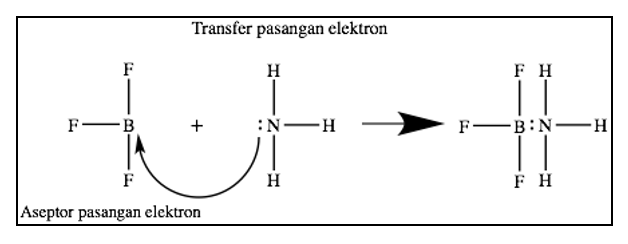
Dari gambar di atas, terlihat bahwa NH3 bertindak sebagai basa Lewis (donor PEB) dan BF3 bertindak sebagai asam Lewis (penerima PEB)

Gimana nih Squad latihan soal dan pembahasan Kimia untuk ujian nasional nanti? Masih kurang? Coba gabung di ruangbelajar deh. Selain video belajar dengan animasi yang keren, ada juga kok latihan soal dan pembahasannya yang pastinya bikin belajar kamu jadi makin mudah. Gabung sekarang yuk.













