Apa Bunyi Hukum Faraday 1 dan 2? | Kimia Kelas 12

Hai RG Squad, sebelumnya kalian sudah tahu kan apa itu Hukum Faraday, dan kenapa kok disebut Hukum Faraday? Atau jangan-jangan kalian belum tahu? Hmm tapi tenang aja, kalau kalian belum tahu, kalian bisa baca di artikel sebelumnya dan pastinya kalian akan mengenal apa itu Hukum Faraday dan kenapa disebut Hukum Faraday.
Baca: Mengenal Bunyi Hukum Faraday
Oke, jika kalian sudah mengenal tentang bunyi Hukum Faraday, pada artikel kali ini kita akan membahas tentang Hukum Faraday 1 dan Hukum Faraday 2. Oke mari baca dan simak secara baik beberapa penjelasan di bawah ini ya, Squad.
Hukum Faraday 1
Apa itu Hukum Faraday 1? Jadi, Hukum Faraday 1 itu merupakan massa zat yang dihasilkan pada suatu electrode selama proses elektrolisis berbanding lurus dengan muatan listrik yang digunakan.
Kita sudah mengetahui bahwa massa zat (w) yang dihasilkan pada elektrode berbanding lurus dengan jumlah molelektron. Sementara, jumlah mol elektron berbanding lurus dengan muatan listrik (Q) dalam elektron. Jadi, dapat disimpulkan:
Massa zat ≈ muatan listrik dalam elektron
w ≈ Q
Dengan Q menunjukan besarnya muatan listrik di suatu titik di kawat jika arus listrik I ampere melewatinya selama t detik. Secara matematis:
Q = I x t
dengan I = arus listrik (ampere) dan t = waktu (detik).
Sehingga, persamaan di atas dapat ditulis menjadi:
w ≈ I x ta
Hukum Faraday 2
Massa zat yang dihasilkan pada elektrode berbanding lurus dengan massa ekivalen zat.
Di dalam Hukum Faraday 2 dinyatakan bahwa massa yang dihasilkan pada elektrode berbanding lurus dengan massa ekivalen zat.
massa zat ≈ massa ekivalen zat
w ≈ ME
Massa ekivalen zat adalah massa atom relatif (Ar) dibagi dengan perubahan bilangan oksidasinya atau muatan ionnya.
ME = Ar/biloks atau muatan ion
Oke kalian sudah paham ya tentang Hukum Faraday 1 dan hukum faraday 2, selanjutnya kita akan lihat beberapa contoh soal hukum faraday nih, Squad.
Contoh Soal Hukum Faraday
Tembaga (Cu) mempunyai Ar =63,5. Berapakah massa ekivalen untuk reaksi berikut?
Cu2+(aq) + 2e– → Cu(s)
Jawab:
Pada reaksi di atas, perubahan bilangan oksidasinya adalah +2.
Jadi, massa ekivalen Cu adalah: ME = Ar/biloks = 63,5/2 = 31,75
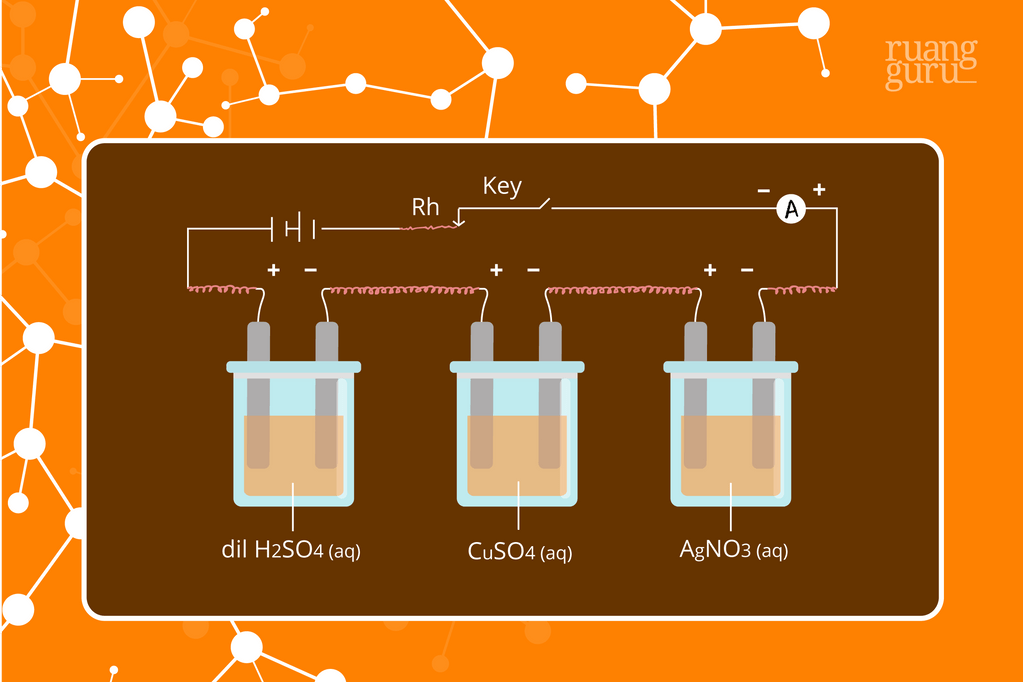
Selanjutnya, jika jumlah listrik sama dialirkan ke dalam dua atau lebih sel elektrolisis dengan elektrolit yang berbeda, maka perbandingan massa zat yang dibebaskan sama dengan perbandingan massa ekivalen zat. Perhatikan gambar di atas, terlihat bahwa jika jumlah listrik yang sama melewati ketiga coulometer, maka massa zat H2, Cu, dan Ag yang dihasilkan akan berbanding lurus dengan massa ekivalennya.

Secara umum, jika terdapat dua macam zat A dan B, maka
Contoh soal Hukum Faraday
Jika pada rangkaian di atas terbenttuk endapan Cu sebesar 5 gram, berapakah massa Ag yang mengendap pada elekrode? (Cu = 63,5; Ag = 108)
Jawab:
Untuk menghitung massa Ag, wAg, gunakan rumus:
Diketahui massa Cu, wCu = 5 gram
Hitung MECu dan MEAg dengan menulis reaksi reduksi Cu dan Ag.
Mari kita lihat kembali Hukum Faraday 1 dan Hukum Faraday 2:
Hukum Faraday 1 : w ≈ I x t
Hukum Faraday 2 : w ≈ ME
Jika digabungkan, kita peroleh w ≈ I x t x ME
Perbandingan ini menjadi persamaan dengan penambahan faktor 1/96.500, sehingga diperoleh rumus hukum faraday :
w = 1/96.500 x I x t x ME
dengan,

Contoh soal Hukum Faraday
Arus listrik 0,2 ampere dilewatkan selama 50 menit ke dalam sel elektrolisis yang mengandung larutan CuCl2. Hitunglah endapan Cu yang terbentuk pada katode. (Ar Cu=63,5)
Jawab:
Hitung endapan Cu, wCu, menggunakan rumus:
wCu = (1/96.500) x I x t x MECu = dim ana ME = Ar/biloks
Diketahui:

Sekarang RG Squad sudah paham kan yang disebut Hukum Faraday 1 dan Hukum Faraday 2 dalam Kimia? Untuk mempermudah kalian dalam memahami materi pelajaran, kalian juga bisa belajar melalui ruangbelajar. Di sana kalian akan belajar menggunakan video animasi dan juga bisa latihan soal lho. So, jangan sampai lupa daftar yaa.













